
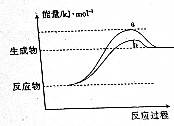
 在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:
在598K的条件下进行人工固氮反应:2N2(g)+6H2O(g)?4NH3(g)+3O2(g),该反应过程中能量变化的曲线如图所示.请回答下列问题:| 温度/K | N2的转化率 |
| 598 | a1 |
| 898 | a2 |
分析 (1)使用催化剂改变反应途径,降低活化能,不影响反应热;
(2)反应物总能量小于生成物总能量,正反应为吸热反应,升高温度平衡正向移动,反应物转化率增大;
(3)598K时,向容积为1L的某恒容密闭容器中加入2mol N2、6mol H2O(g)及固体催化剂,平衡时容器内的压强为起始时的93.75%,物质的量减少(2+6)mol×(1-93.75%)=0.5mol,则:
2N2(g)+6H2O(g)?4NH3(g)+3O2(g)物质的量减小△n=1
起始量(mol):2 6 0 0
变化量(mol):1 3 2 1.5 0.5
平衡量(mol):1 3 2 1.5
①转化率=$\frac{物质的量变化量}{起始物质的量}$×100%;
②平衡常数K=$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$.
解答 解:(1)由图可知,由a变为b活化能降低,反应热不变,应是使用催化剂,
故答案为:使用催化剂;
(2)反应物总能量小于生成物总能量,正反应为吸热反应,升高温度平衡正向移动,反应物转化率增大,则:则a1<α2,
故答案为:<;
(3)598K时,向容积为1L的某恒容密闭容器中加入2mol N2、6mol H2O(g)及固体催化剂,平衡时容器内的压强为起始时的93.75%,物质的量减少(2+6)mol×(1-93.75%)=0.5mol,则:
2N2(g)+6H2O(g)?4NH3(g)+3O2(g)物质的量减小△n=1
起始量(mol):2 6 0 0
变化量(mol):1 3 2 1.5 0.5
平衡量(mol):1 3 2 1.5
①氮气的转化率=$\frac{1mol}{2mol}$×100%=50%,
故答案为:50%;
②平衡常数K=$\frac{{c}^{4}(N{H}_{3})×{c}^{3}({O}_{2})}{{c}^{2}({N}_{2})×{c}^{6}({H}_{2}O)}$=$\frac{{2}^{4}×1.{5}^{3}}{{1}^{2}×{3}^{6}}$=$\frac{2}{27}$,
故答案为:$\frac{2}{27}$.
点评 本题考查化学平衡计算、化学反应中能量变化,掌握三段式在化学平衡计算中应用,难度不大.


 计算高手系列答案
计算高手系列答案科目:高中化学 来源: 题型:选择题
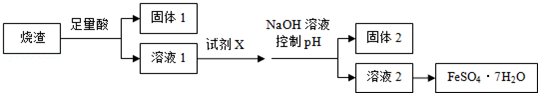
| A. | 溶解烧渣选用足量硫酸,试剂X选用铁粉 | |
| B. | 固体1中一定含有SiO2,控制pH是为了使Al3+转化为Al3,进入固体2 | |
| C. | 从溶液2得到FeSO4•7H2O产品的过程中,须控制条件防止其氧化和分解 | |
| D. | 若改变方案,在溶液1中直接加NaOH至过量,得到的沉淀用硫酸溶解,其溶液经结晶分离也可得到FeSO4•7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,18gH218O所含质子数为10NA | |
| B. | 1mol的-OH与1mol的OH-所含电子数均为10NA | |
| C. | 常温常压下,42g乙烯和丁烯混合气体中,极性键数为6NA | |
| D. | Na2O2的反应中,每生成0.1molO2,转移电子数目为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| a | b | ||||||||||||||||
| c | d | ||||||||||||||||
| e | f | g | h | i | |||||||||||||
| j | |||||||||||||||||
| 锂 | X | Y | |
| 失去第一个电子 | 519 | 502 | 580 |
| 失去第二个电子 | 7296 | 4570 | 1820 |
| 失去第三个电子 | 11799 | 6920 | 2750 |
| 失去第四个电子 | 9550 | 11600 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 族周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | ④ | ||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ⑨ | ⑩ | ⑪ | ⑫ |
 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com