
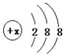
 有几种元素的微粒电子层结构如图所示,其中:
有几种元素的微粒电子层结构如图所示,其中: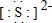 .
. 分析 (1)该微粒属于电中性粒子,则质子数等于核外电子数=2+8+8=18,元素质子数等于原子序数;
(2)盐溶液中的某微粒与AgNO3溶液反应时会出现白色浑浊,则该微粒是氯离子,氯离子和银离子反应生成AgCl白色沉淀;
(3)某微粒具有还原性,且这种微粒失去2个电子即变为原子,且离子核外电子数是18,则该微粒质子数=18-2=16,为硫离子.
解答 解:(1)该微粒属于电中性粒子,则质子数等于核外电子数=2+8+8=18,元素质子数等于原子序数,所以该微粒为Ar,故答案为:Ar;
(2)盐溶液中的某微粒与AgNO3溶液反应时会出现白色浑浊,且离子核外有18个电子,则该微粒是Cl-,氯离子和银离子反应生成AgCl白色沉淀,离子方程式为Cl-+Ag+=AgCl↓,
故答案为:Cl-;Cl-+Ag+=AgCl↓;
(3)某微粒具有还原性,且这种微粒失去2个电子即变为原子,且离子核外电子数是18,则该微粒质子数=18-2=16,为S 2-,电子式为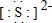 ,故答案为:S 2-;
,故答案为:S 2-;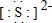 .
.
点评 本题考查离子方程式的书写、原子结构示意图、电子式等知识点,明确电子式、质子数与电荷关系即可解答,注意硫离子书写特点,为易错点.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
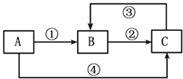 A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )
A、B、C三种物质中均含有同一种元素M,它们之间有如下图所示的转化关系(部分反应物质已略去).A为一种金属单质,反应①②③均为化合反应,反应④为置换反应.下列有关说法不正确的是( )| A. | ①中所加试剂可能是氯气 | |
| B. | ③中需要加具有氧化性的试剂 | |
| C. | A与稀硝酸反应一定能实现元素M在①中发生的价态变化 | |
| D. | 元素M在②中发生的价态变化也能通过加碘化钾溶液实现 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
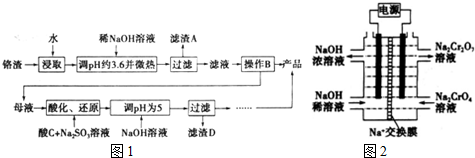
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
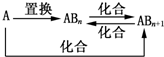
| A. | 图中物质间的转化都不是氧化还原反应 | |
| B. | 当n=1时,A可能是N2 | |
| C. | A一定是金属元素 | |
| D. | 当n=2时,A可能是Fe |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
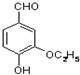 是食品添加剂的增香原料,其香味比香草醛更浓郁.
是食品添加剂的增香原料,其香味比香草醛更浓郁.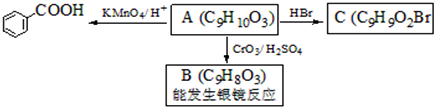
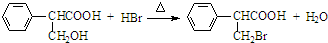 ,属于取代反应(填反应类型).
,属于取代反应(填反应类型). .
. .
.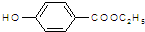 )是一种医药中间体,请设计合理方案用
)是一种医药中间体,请设计合理方案用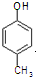 合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).
合成D.(其他原料自选,用反应流程图表示并注明必要的反应条件).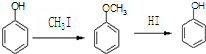

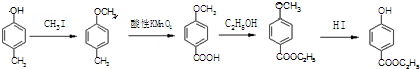
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳的燃烧热等于110.5KJ/mol | |
| B. | 2C(s)+2O2(g)=2CO2(g);△H>-221 KJ/mol | |
| C. | 浓硫酸与稀NaOH溶液反应的中和热为-57.3 KJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出热量小于57.3 KJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | c(Na+)>c(CO32-)>c(H+)>c(OH-) | B. | c(Na+)+c(H+)=c(HCO3-)+c(OH-)+c(CO32-) | ||
| C. | c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-) | D. | c(H+)+c(HCO3-)+2 c(H2CO3)=c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | N2、H2和NH3的质量分数不再改变 | |
| B. | c(N2):c(H2):c(NH3)=1:3:2 | |
| C. | N2与H2的物质的量之和是NH3的物质的量2 | |
| D. | 单位时间里每增加1 mol N2,同时增加3 mol H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
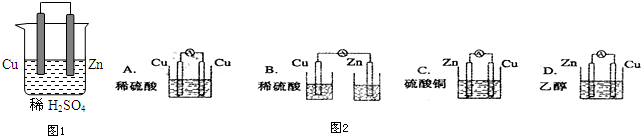
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com