
分析 (1)根据化学式中化合价的代数和为0判断铁元素的化合价,据化合价的升降判断铁元素被氧化还是被还原;
(2)根据胶体的直径判断Fe(OH)3胶体微粒直径,;实验室制备Fe(OH)3胶体的化学方程式为FeCl3+3H2O$\frac{\underline{\;加热\;}}{\;}$Fe(OH)3胶体+3HCl,根据盐的电离方程式书写规则书写铁酸钠的电离方程式.
解答 解:(1)设铁元素的化合价为x,化学式中化合价的代数和为0,所以(+1)×2+x+(-2)×4=0,解得x=+6,
Fe(NO3)3中铁元素的化合价为+3价,铁酸钠中,铁元素的化合价是+6价,铁元素失电子化合价升高,被氧化,故答案为:+6;氧化;
(2)胶体微粒直径的范围是1-100nm之间,所以Fe(OH)3胶体微粒直径的范围是1-100nm之间;实验室制备Fe(OH)3胶体的化学方程式为FeCl3+3H2O$\frac{\underline{\;加热\;}}{\;}$Fe(OH)3胶体+3HCl;铁酸钠溶解于水,立即与水发生剧烈反应,所以铁酸钠是强电解质,在水中完全电离成钠离子和铁酸根离子,电离方程式为Na2FeO4=2Na++FeO42-,
故答案为:1-100nm;FeCl3+3H2O$\frac{\underline{\;加热\;}}{\;}$Fe(OH)3胶体+3HCl;Na2FeO4=2Na++FeO42-.
点评 本题考查的都是基础知识,属容易题,在学习时要注重基础知识的积累.


科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,4g H2含有的分子数为 2NA | |
| B. | 18g H2O在标准状况下的体积是22.4L | |
| C. | 2.3g金属钠变为钠离子时失去的电子数为NA | |
| D. | 通常状况下,NA个CO2分子占有的体积为22.4L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两溶液中由水电离出c(H+)都是1.0×10-12 mol•L-1 | |
| B. | NaOH溶液和盐酸中由水电离出c(OH-)分别为1.0×10-2mol•L-1、1.0×10-12 mol•L-1 | |
| C. | 两溶液中由水电离出的c(H+)相等 | |
| D. | 两者都促进了水的电离 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )
肼(N2H2)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示.肼能与双氧水发生反应:N2H4+2H2O2═N2+4H2O.用NA表示阿伏伽德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2LN2中含电子总数为5NA | |
| B. | 标准状况下,22.4LN2H4中所含原子总数为6NA | |
| C. | 标准状况下,3.2gN2H4中含有共价键的总数为0.6NA | |
| D. | 若生成3.6gH2O,则上述反应转移电子的数目为0.2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 124g P4含有的P-P键数为4NA(设NA表示阿伏伽德罗常数的值) | |
| B. | Be和NaOH溶液反应的离子方程式是:2Be+2OH -+2H2O=2BeO2-+3H2↑ | |
| C. | 在NaCl溶液中加入AgNO3溶液,生成白色沉淀;再加入氨水,沉淀消失,沉淀消失发生的离子方程式是: AgCl+2NH3•H2O=[Ag(NH3)2]++Cl-+2H2O | |
| D. | 0.1mol/L的Fe3+溶液中,能大量共存的离子有Cl-、SO42-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
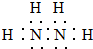 ,其中氮的化合价为-2;
,其中氮的化合价为-2;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 为保护海轮的船壳,常在船壳上镶入锌块 | |
| B. | 纯碱溶于热水中,去污效果增强,说明纯碱的水解反应是吸热反应 | |
| C. | 已知工业合成氨△H<O,达平衡后,升高温度,正反应速率减少、逆反应速率增大,平衡向逆反应方向移动 | |
| D. | NH3(g)+HCl(g)═NH4Cl(s)较低温下能自发进行,说明该反应的△H<O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 混凝法,用明矾做混凝剂:Al3++3H2O?Al(OH)3+3H+ | |
| B. | 中和法,用过量CO2中和碱性废水:CO2+2OH-═CO32- | |
| C. | 沉淀法,用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ | |
| D. | 氧化还原法,用FeSO4将酸性废水中Cr2O72-还原为Cr3+:Cr2O72-+6Fe2++14H+═2Cr3++6Fe3++7H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢氧化钠的摩尔质量是40 g | |
| B. | 1 mol硫酸的质量是98g•mol-1 | |
| C. | 甲烷的摩尔质量就是它的相对分子质量 | |
| D. | 17 g NH3含N原子数是6.02×1023个 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com