
【题目】常温下,![]() 某一元碱
某一元碱![]() 与
与![]() 盐酸反应,反应过程中由水电离的
盐酸反应,反应过程中由水电离的![]() 浓度的负对数
浓度的负对数![]() 与所加盐酸的体积间关系如图,下列说法正确的是( )
与所加盐酸的体积间关系如图,下列说法正确的是( )
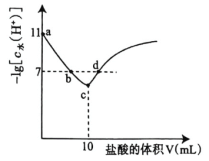
A.水的电离程度![]()
B.![]() 点溶液满足
点溶液满足![]()
C.![]() 为弱碱,其电离平衡常数
为弱碱,其电离平衡常数![]() 约为
约为![]()
D.![]() 点溶液满足
点溶液满足![]()
【答案】A
【解析】
图中c点![]() 最小推出c点为恰好完全反应点,
最小推出c点为恰好完全反应点,![]() <7说明
<7说明![]() 发生盐的水解,说明BOH为弱碱;以a点溶质全部是BOH,来计算
发生盐的水解,说明BOH为弱碱;以a点溶质全部是BOH,来计算![]() 值。
值。
A.a点溶质是BOH,为碱性溶液,抑制水的电离,b、d点的pH=7,为中性溶液,c点是盐酸与BOH恰好完全反应的点,得到BCl盐溶液,呈酸性,![]() 的水解促进水的电离,故水的电离程度c>d=b>a,A正确;
的水解促进水的电离,故水的电离程度c>d=b>a,A正确;
B. c点溶质为BCl,由质子守恒可得:![]() ,d点HCl过量,则
,d点HCl过量,则![]() ,B错误;
,B错误;
C.a点加入盐酸的量为0,溶液溶质为BOH,由此可知常温下BOH电离的![]() ,
,![]() ,则BOH为弱碱,且
,则BOH为弱碱,且![]() 的数量级为
的数量级为![]() ,C错误;
,C错误;
D.c点![]() 最小,c点HCl与BOH恰好完全反应得BCl溶液,
最小,c点HCl与BOH恰好完全反应得BCl溶液,![]() ,根据物料守恒:
,根据物料守恒:![]() ,D错误;
,D错误;
答案选A。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】科学家在 20℃时,将水置于足够强的电场中,水分子瞬间凝固成“暖冰”。对“暖冰”与其它物质比较正确的是( )
A.与Na2O 晶体类型相同B.与![]() 化学键类型相同
化学键类型相同
C.与CO2 分子构型相同D.与 CH4 分子极性相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯碱工业的一种节能新工艺是将电解池与燃料电池相组合,相关物料的传输与转化关系如图所示(电极未标出)。下列说法正确的是
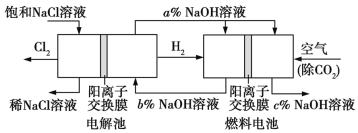
A. 电解池的阴极反应式为2H2O+2e-![]() H2↑+2OH-
H2↑+2OH-
B. 通入空气的电极为负极
C. 电解池中产生2 mol Cl2时,理论上燃料电池中消耗0.5 mol O2
D. a、b、c的大小关系为a>b=c
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下的一密闭容器中事先放入1.56g过氧化钠,然后再通入乙烷与氧气的混合气体,用电火花引爆,直至反应完全为止,恢复到原温度,容器内压强近似为零。
(1)相同条件下,通入的气体氧气和乙烷的体积比是多少?_____
(2)通入氧气的质量最大应是多少?_____
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是( )
A. 铅蓄电池的正极反应为PbO2+4H++2e-===Pb2++2H2O
B. 以CO和O2构成的碱性燃料电池负极电极反应式为CO+4OH--2e-===CO![]() +2H2O
+2H2O
C. 电解法精炼铜时,以粗铜作阴极,纯铜作阳极
D. 工业上通过电解氯化钠溶液制备金属钠和氯气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)2019年诺贝尔化学奖颁给了三位在锂电池领域做出突出贡献的科学家。
①基态锂原子核外有________种不同空间运动状态的电子。
②![]() 状态的锂到
状态的锂到![]() 状态的锂所得的原子光谱是________光谱。
状态的锂所得的原子光谱是________光谱。
③锂和铍相比,锂的第Ⅱ电离能________(填“>”“<”或“=”)铍的第Ⅱ电离能。
(2)某锂离子电池的正极材料为![]() 。
。
①基态![]() 原子价层电子的电子排布图(轨道表达式)是________。
原子价层电子的电子排布图(轨道表达式)是________。
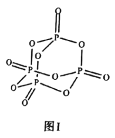
②磷元素是生物体不可缺少的元素之一,把一种填有![]() 的苏打石灰玻璃移植到体内,钙离子和磷酸根离子在玻璃和骨头的间隙中溶出,有助于诱导新的骨骼生成。
的苏打石灰玻璃移植到体内,钙离子和磷酸根离子在玻璃和骨头的间隙中溶出,有助于诱导新的骨骼生成。![]() 的结构如图I所示,其中
的结构如图I所示,其中![]() 原子的杂化方式是________,
原子的杂化方式是________,![]() 是________(填“极性”或“非极性”)分子。
是________(填“极性”或“非极性”)分子。
③![]() 原子形成的含氧酸有很多种结构,图Ⅱ是某种多聚磷酸根的结构示意图。这种多聚磷酸的化学式为________(用
原子形成的含氧酸有很多种结构,图Ⅱ是某种多聚磷酸根的结构示意图。这种多聚磷酸的化学式为________(用![]() 表示磷原子的个数)。
表示磷原子的个数)。

(3)某锂电池负极材料晶体中![]() 嵌入两层石墨层中导致石墨堆积方式发生改变,形成如图Ⅲ所示的晶体结构。
嵌入两层石墨层中导致石墨堆积方式发生改变,形成如图Ⅲ所示的晶体结构。
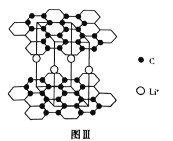
①石墨是一种导体,但石墨的导电性只能沿石墨平面的方向,原因是________。
②已知最近碳一碳原子间的距离是![]() ,则最近锂一锂离子间的距离是________
,则最近锂一锂离子间的距离是________![]() ;石墨层之间的距离是
;石墨层之间的距离是![]() (其中
(其中![]() ),
),![]() 表示阿伏加德罗常数的值,该晶体的密度是________
表示阿伏加德罗常数的值,该晶体的密度是________![]() (列出计算式即可)。
(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列依据热化学方程式得出的结论正确的是
A. 已知2SO2(g)+O2(g)![]() 2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
2SO3(g)为放热反应,则SO2的能量一定高于SO3的能量
B. 若C(石墨,s)=C(金刚石,s) ΔH>0,则石墨比金刚石稳定
C. 已知NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l) ΔH=-57.4 kJ·mol-1,则20.0 g NaOH固体与稀盐酸完全中和,放出28.7 kJ的热量
D. 已知2C(s)+2O2(g)=2CO2(g) ΔH1;2C(s)+O2(g)=2CO(g) ΔH2,则ΔH1>ΔH2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出指定物质对应的化学式。消毒剂碘伏中含有碘分子_____________,胶卷中必不可少的感光材料_____________,加碘盐中含有碘酸钾_____________,发酵粉含有小苏打_____________。
(2)化工厂镁着火,不能用二氧化碳灭火,用化学方程式解释__________________________。
(3)电解饱和食盐水是氯碱工业的基础,写出化学方程式__________________________。
(4)稀醋酸处理热水瓶中水垢(主要成分为碳酸钙)的离子方程式__________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com