
| A、c(Na+)+c(H+)=2c(CO32-)+c(HCO3-)+c(OH-) |
| B、c(Na+)={c(CO32-)+c(HCO3-)+c(H2CO3)} |
| C、c(OH-)=c(H+)+c(HCO3-)+2c(H2CO3) |
| D、c(Na+)>c(HCO3-)>c(OH-)>c(H+) |


科目:高中化学 来源: 题型:
| A、HClO是强酸 |
| B、根据分散系是否具有丁达尔现象将分散系分为溶液、胶体和浊液 |
| C、Fe在足量Cl2中燃烧只生成FeCl3 |
| D、二氧化硅是将太阳能转化为电能的常用材料 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol
已知T1时反应H2(g)+I2(g)?2HI(g);△H=-14.9kJ/mol| t(min) n(mol) 物质 | 0 | 2 | 4 | 6 | 8 | 10 |
| H2 | 0 | 0.174 | 0.224 | 0.244 | 0.244 | 0.244 |
| I2 | 0 | 0.174 | 0.224 | 0.244 | 0.244 | 0.244 |
| HI | 2 | 1.652 | 1.552 | 1.512 | 1.512 | 1.512 |
查看答案和解析>>
科目:高中化学 来源: 题型:
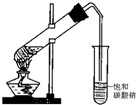

查看答案和解析>>
科目:高中化学 来源: 题型:
 ,此烷烃的一溴代物有
,此烷烃的一溴代物有
查看答案和解析>>
科目:高中化学 来源: 题型:
| CH3C≡CNa |

| 浓硫酸 |
| 170℃ |
| Br2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
 三氯化铁是中学化学实验室中不可缺少的重要试剂.
三氯化铁是中学化学实验室中不可缺少的重要试剂.查看答案和解析>>
科目:高中化学 来源: 题型:
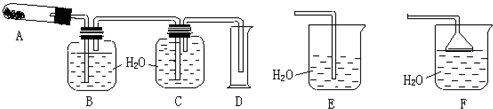
查看答案和解析>>
科目:高中化学 来源: 题型:

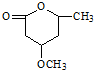 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从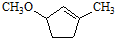 到
到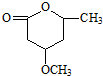 的合成路线(用合成路线流程图表示,并注明反应条件).
的合成路线(用合成路线流程图表示,并注明反应条件). …
…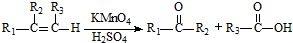 ;
;| 浓H2SO4 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com