
【题目】参考下列(a)~(c)项回答问题:
(a)皂化值是使1g油脂皂化所需要的KOH的毫克数。
(b)碘值是使100g油脂加成碘的克数。
(c)各种油脂的皂化值、碘值列表如下:
花生油 | 亚麻仁油 | 牛油 | 黄油 | 硬化大豆油 | 大豆油 | |
皂化值 | 190 | 180 | 195 | 226 | 193 | 193 |
碘值 | 90 | 182 | 38 | 38 | 5 | 126 |
(1)单纯由(C17H33COO)3C3H5(相对分子质量884)形成的油,皂化值是
(2)在横线上填入适当的词句:
亚麻仁油比花生油所含的_________________多,黄油比牛油的_________________小。硬化大
豆油的碘值小的原因是_________ ________。
(3)为使碘值为180的鱼油100 g硬化所需要的H2的体积为 升(标准状况下)?
(4)结构简式为 的酯,若皂化值为430,求n为
的酯,若皂化值为430,求n为
【答案】(1)190 (2分)(2)碳碳双键(1分) 平均相对分子质量(1分) 硬化大豆油已经过硬化处理,含碳碳双键很少,所以碘值很小(2分)(3)15.9 L(2分) (4)n=4(2分)
【解析】
试题分析:(1)油脂都是高级脂肪酸甘油酯,发生皂化时,1 mol油脂消耗3 mol KOH。
油脂 ~ 3KOH
884 3×56
1 g m(KOH)
m(KOH)= ![]() ,即皂化值为190。
,即皂化值为190。
(2)①亚麻仁油和花生油相比,皂化值相近,但碘值要大近两倍,说明亚麻仁油所含的碳碳双键多。②黄油比牛油的皂化值大,而碘值相等,说明黄油的平均相对分子质量较小,分子中碳碳双键较多。③硬化大豆油碘值很小,是因为已经经过硬化处理,含有的碳碳双键很少。
(3)碘值是100 g油脂加成碘的克数,不饱和烃基加成碘或氢气的物质的量相等,故有:
I2 ~ H2
254 22.4 L
180 g V
V=![]()
![]()
(4)此酯水解时,1 mol酯消耗1 mol KOH,即:
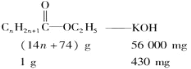
解得n=4。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】将32.5gZn投入到vmL浓硫酸中,共热,恰好完全反应,则可以确定的数据是( )
A.所得气体在标准状况下的体积 B.所得气体的质量
C.所得溶液的浓度 D.原硫酸的浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
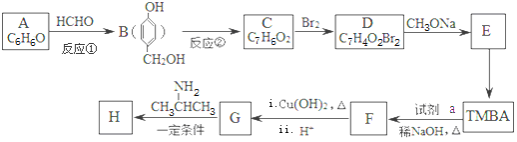
【题目】【2016届 江西省五市八校第二次联考】【化学——选修5:有机化学】
以有机物A为原料合成重要精细化工中间体TMBA(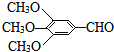 )和抗癫痫药物H(
)和抗癫痫药物H( )的路线如图(部分反应略去条件和试剂):
)的路线如图(部分反应略去条件和试剂):
已知:I.RONa+R′X→ROR′+NaX;
II.RCHO+ R′CH2CHO ![]()
![]() +H2O(R、R′表示烃基或氢)
+H2O(R、R′表示烃基或氢)
(1)A的名称是 ;C能发生银镜反应,则C分子中含氧官能团的名称是 .
(2)①和②的反应类型分别是 、 .
(3)E的结构简式是 ,试剂a的分子式是 .
(4)C→D的化学方程式是 .
(5)D的同分异构体有多种,其中属于芳香族酯类化合物的共有 种.
(6)F与新制Cu(OH)2悬浊液发生反应的化学方程式是 .
(7)已知酰胺键(![]() )有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 。
)有类似酯基水解的性质,写出抗癫痫病药物H与足量NaOH溶液发生反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中可能含有SO42-、CO32-、Cl-。为了检验其中是否含有SO42-,除BaCl2溶液外,还需要的溶液是
A.H2SO4 B.HCl C.NaOH D.NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图依次为气体制得、除杂并检验其性质的装置(加热及夹持仪器省略)。下列设计不能达到目的的是( )
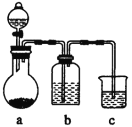
选项 | 气体 | 装置中药品 | ||
a | b | c | ||
A | C2H2 | 饱和食盐水+电石 | CuS04溶液 | 溴水 |
B | CO2 | 稀盐酸+石灰石 | 饱和NaHC03溶液 | 苯酚蚋溶液 |
C | C2H4 | 溴乙烷+ NaOH乙醇溶液 | 水 | K2z Cr207,酸性溶液 |
D | SO2 | 碳+浓硫酸 | 新制氯水 | 品红溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D四种元素的原子序数依次递增,A、B的基态原子中L层未成对电子数分别为3、2,C在短周期主族元素中电负性最小,D元素被称为继铁、铝之后的第三金属,其合金多用于航天工业,被誉为“21世纪的金属” ,其基态原子外围电子占据两个能级且各能级电子数相等。请回答下列问题:
(1)A、B、C三种元素的第一电离能由小到大的顺序是_______(填元素符号)。
(2)D元素基态原子的核外电子排布式为____________________。
(3)白色晶体C3AB4中阴离子的空间立体构型是_______,中心原子的杂化方式是_____
(4)中学化学常见微粒中与A2B互为等电子体的分子有__________(任写一种即可)。
(5)已知D3+可形成配位数为6的配合物。现有组成皆为DCl3·6H2O的两种晶体,一种为绿色,另一种为紫色。为测定两种晶体的结构,分别取等量样品进行如下实验:
①将晶体配成水溶液,
②滴加足量AgNO3溶液,
③过滤出AgCl沉淀并进行洗涤、干燥、称量;
经实验测得产生的沉淀质量:绿色晶体是紫色晶体的2/3。依据测定结果可知绿色晶体的化学式为_______________,该晶体中含有的化学键有__________
a.离子键 b.极性键 c.非极性键 d.配位键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)甲醇是重要的化工原料,又可做燃料。利用合成气(主要成分为CO、CO2和H2)在催化剂的作用下合成甲醇,主要反应如下:
①CO(g)+2H2(g)![]() CH3OH(g) △H1
CH3OH(g) △H1
②CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) △H2= -58 kJ/mol
CH3OH(g)+H2O(g) △H2= -58 kJ/mol
③CO2(g)+H2(g)![]() CO(g)+H2O(g) △H3
CO(g)+H2O(g) △H3
已知反应①中的相关的化学键键能数据如下:
化学键 | H-H | C-O | C (CO中的化学键) | H-O | C-H |
E/(kJ/mol) | 436 | 343 | 1076 | 465 | 413 |
回答下列问题:
①△H3=_____kJ/mol
②25℃,101 kPa条件下,测得16g甲醇完全燃烧释放出Q kJ的热量,请写出表示甲醇燃烧热的热化学方程式_______________
(2)25℃,将a mol·L-1氨水与b mol·L-1盐酸等体积混合后溶液呈中性,则此时溶液中c(NH4+)__________c(Cl-)(填“>”、“<”或“﹦”);用含a、b的代数式表示该温度下NH3·H2O的电离平衡常数Kb = _________
(3)800℃时,在2L密闭容器中发生反应2NO(g)+O2(g)![]() 2NO2(g),在反应体系中,n(NO)随时间的变化如下表所示:
2NO2(g),在反应体系中,n(NO)随时间的变化如下表所示:
时间(s) | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)(mol) | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
①下图中表示NO2变化的曲线是___________用O2表示从0~2s内该反应的平均速率v=____
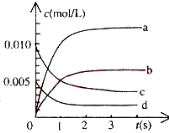
②能说明该反应已经达到平衡状态的是_______
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内的密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2011年中国已超北美成为全球液晶显示器第二大市场。生产液晶显示器的过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12000~20000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
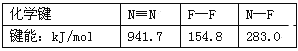
下列说法中不正确的是 ( )
A.过程F2(g)→2F(g)吸收能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)=2NF3(g)的ΔH<0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)目前,汽车厂商常利用催化技术将尾气中的NO和CO转化成CO2和N2,化学方程式如下:2NO+2CO![]() 2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
2CO2+N2。为研究如何提高该转化过程反应速率,某课题组进行了以下实验探究。
【资料查阅】①不同的催化剂对同一反应的催化效率不同;
②使用相同的催化剂,当催化剂质量相等时,催化剂的比表面积对催化效率有影响。
【实验设计】课题组为探究某些外界条件对汽车尾气转化反应速率的影响规律,设计了以下对比实验。
(1)完成以下实验设计表(表中不要留空格)。

【图像分析与结论】利用气体传感器测定了三组实验中CO浓度随时间变化的曲线图,如下:
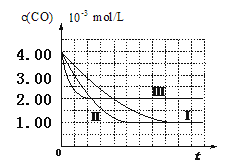
(2)计算第Ⅰ组实验中,达平衡时NO的浓度为__________________; NO 的转化率为
(3)由曲线Ⅰ、Ⅱ可知,增大催化剂比表面积,汽车尾气转化速率_____________(填“增大”、“减小”、“无影响”)。
(II)随着世界粮食需求量的增长,农业对化学肥料的需求量越来越大,其中氮肥是需求量最大的一种化肥。而氨的合成为氮肥的生产工业奠定了基础,其原理为:N2+3H2![]() 2NH3
2NH3
(1)在N2+3H2![]() 2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
2NH3的反应中,一段时间后,NH3的浓度增加了0.9mol·L-1。用N2表示其反应速率为0.15 mol·L-1·s-1,则所经过的时间为 ;
A.2 s B.3 s C.4 s D.6 s
(2)下列4个数据是在不同条件下测得的合成氨反应的速率,其中反应最快的是 ;
A.v(H2)=0.1 mol·L-1·min-1 B.v(N2)=0.1 mol·L-1·min-1
C.v(NH3)=0.15 mol·L-1·min-1 D.v(N2)=0.002mol·L-1·s-1
(3)在一个绝热(与外界没有热交换)、容积不变的密闭容器中发生可逆反应:N2(g)+3H2(g)![]() 2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
2NH3(g) △H<0。下列各项能说明该反应已经达到平衡状态的是 。
A.容器内气体密度保持不变 B.容器内温度不再变化 C.断裂1mol N≡N键的同时,生成6 mol N—H键 D. 2v正(H2)=3v逆(NH3) E.反应混合气体的平均相对分子质量不变 F.C(H2): C(N2): C(NH3)= 3:1:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com