
分析 (1)若剩余的4.80g固体全是MnO2,m(KClO3)=16.60g-4.80g;
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则5g水溶解氯化钾得到的溶液是饱和溶液,据此计算其溶解度;反应前后质量减少的质量为氧气的质量,根据氯酸钾和氧气之间的关系式计算氯酸钾的质量;根据溶液质量、密度计算溶液体积,再结合c=$\frac{n}{V}$计算溶液的物质的量浓度;
解答 解:(1)若剩余的4.80g固体全是MnO2,m(KClO3)=16.60g-4.80g=11.80g,
故答案为:11.80;
(2)若剩余的4.80g固体是MnO2和KCl的混合物,则5g水溶解氯化钾得到的溶液是饱和溶液,5g水溶解KCl的质量=6.55g-4.80g=1.75g,
(a)则100g水溶解KCl的质量=$\frac{1.75g}{5g}$×100g=35g,答:25℃时KCl的溶解度35g;
(b)20g水溶解氯化钾的质量=1.75g×4=7g,反应前后质量减少的质量为氧气的质量,氧气的质量=16.60g-7g-4.80g=4.8g,根据氧原子守恒得$\frac{\frac{4.8g}{16g/mol}}{3}$×122.5g/mol=12.25,答:原混合物中KClO3的质量12.25g;
(c)溶液的质量=20g+7g=27g,溶液的体积=$\frac{27g}{1.72g/mL}$,n(KCl)=$\frac{7g}{74.5g/mol}$,则溶液的物质的量浓度=$\frac{\frac{7g}{74.5g/mol}}{\frac{27g}{1.72g/mL}}$=5.99mol/L,
答:溶液的物质的量浓度为5.99mol/L.
点评 本题考查了混合物的计算,涉及物质的量浓度的计算、溶解度的计算、物质间的反应等知识点,根据物质之间的关系式进行计算,注意结合原子守恒进行解答,题目难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | ④>②>③>① | B. | ①>④>②>③ | C. | ①>②>③>④ | D. | ④>①>③>② |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | KCl的摩尔质量是:74.5g | B. | 一水合氨的化学式为:NH4•OH | ||
| C. | Na2O2中的阴离子为:O2- | D. | 镁的原子结构示意图如图所示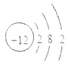 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
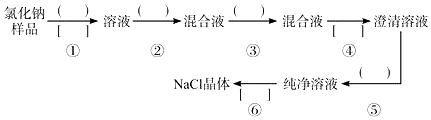
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ba(OH)2•8H2O与NH4Cl晶体混合 | B. | 盐酸与NaOH溶液混合 | ||
| C. | 炽热的碳与二氧化碳反应 | D. | Al片投入盐酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com