
| A. | HCl | B. | H2SO4 | C. | H2O | D. | CaCl2 |
分析 活泼金属和活泼非金属元素之间易形成离子键,非金属元素之间易形成共价键,含有离子键的化合物是离子化合物,离子化合物中可能含有共价键,只含共价键的化合物是共价化合物,据此分析解答.
解答 解:A.HCl分子中H-Cl原子之间只存在共价键,为共价化合物,故A错误;
B.硫酸分子中H-O、O-S原子之间只存在共价键,为共价化合物,故B错误;
C.水分子中H-O原子之间只存在共价键,为共价化合物,故C错误;
D.氯化钙中氯离子和钙离子之间只存在离子键,为离子化合物,故D正确;
故选D.
点评 本题考查离子键化合物和共价化合物判断,为高频考点,侧重考查学生分析判断能力,明确物质构成微粒及微粒之间作用力是解本题关键,注意D中两个氯离子之间不存在化学键,为易错点.


科目:高中化学 来源: 题型:选择题
| A. | 将NH3通入AgN03溶液中,再加几滴葡萄糖溶液,加热后有银镜产生,证明葡萄糖有氧化性 | |
| B. | 配制Fe(N03)2溶液时,向Fe(N03)2溶液中加几滴稀硫酸,以防止Fe(N03)2发生水解 | |
| C. | 向NaI溶液中加入少量CCl4振荡,未见蓝色,说明NaI没有变质 | |
| D. | 剪取一小块铝箔,投入到NaOH溶液中,观察到在被剪断处先产生气体,说明铝在空气中易被氧化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
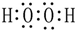 .
.
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
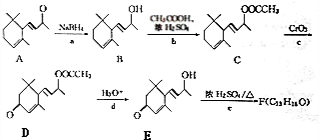
 .(已知一个碳原子上不能连接两个碳碳双键)
.(已知一个碳原子上不能连接两个碳碳双键)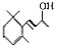 +CH3COOH$→_{△}^{浓硫酸}$、
+CH3COOH$→_{△}^{浓硫酸}$、 +H2O.
+H2O.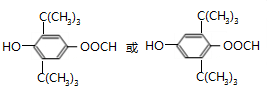
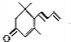
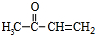 为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线.
为原料制备聚1,3-丁二烯-{CH2-CH=CH-CH2}-n的合成路线.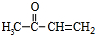 $\stackrel{NaBH_{4}}{→}$
$\stackrel{NaBH_{4}}{→}$ $→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$
$→_{△}^{NaOH醇溶液}$CH2=CHCH=CH2$\stackrel{一定条件}{→}$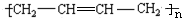 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 阴、阳离子通过静电吸引形成的强烈的相互作用 | |
| B. | 只由非金属元素组成的化合物不可能是离子化合物 | |
| C. | 金属元素与非金属元素化合时,不一定形成离子键 | |
| D. | 只有活泼金属与活泼非金属之间才能形成离子键 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 苯酚有一定毒性,不能用作消毒剂和防腐剂 | |
| B. | 制作航天服的聚酯纤维和用于光缆通信的光导纤维都是新型无机非金属材料 | |
| C. | 乙醇和乙酸都是常用调味品的主要成分 | |
| D. | 可将工业酒精兑水后饮用,因为其中含有甲醇、乙醇,它具有醇香味 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向移动 | B. | 气体C的体积分数增大 | ||
| C. | m+n>p | D. | 气体A的转化率升高 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com