
【题目】(1)写出NaHSO4溶液的电离方程式_____; 写出Na2CO3水解的离子方程式_____ ;
(2)25℃时,pH= a的NaOH溶液中, 溶液的C(OH-) =_____ mol/L。
(3)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(请用相应字母填)
①当三种酸物质的量浓度相同时,c(H+)由大到小的顺序是______。
②同体积、同物质的量浓度的三种酸,中和NaOH的能力由大到小的顺序是_____。
③若三者pH相同且体积相等,中和NaOH的能力由大到小的顺序是________。
(4)有下列盐溶液:①MgCl2 ②KNO3 ③KClO ④CH3COONH4 ⑤NaCN⑥Fe2(SO4)3,呈酸性的是________,呈碱性的是________,呈中性的是________(用相应的序号填写)。
(5)请写出明矾(K Al(SO4)212H2O)做净水剂净水时的离子方程式____________;
(6)请写出泡沫灭火器(硫酸铝和碳酸氢钠溶液)灭火时发生反应的离子方程式:____________;
(7)物质的量浓度相同的 氯化铵;②碳酸氢铵;③ 硫酸氢铵;④硫酸铵4种溶液中,c(![]() )由大到小的顺序是_____ (请用相应的序号填写)
)由大到小的顺序是_____ (请用相应的序号填写)
【答案】NaHSO4=Na++H++![]()
![]() +H2O
+H2O![]()
![]() +OH-
+OH- ![]() b>a>c b>a=c c>a=b ①⑥ ③⑤ ②④ Al3++3H2O
b>a>c b>a=c c>a=b ①⑥ ③⑤ ②④ Al3++3H2O![]() Al(OH)3+3H+ Al3++3
Al(OH)3+3H+ Al3++3![]() = 3CO2↑+Al(OH)3↓ ④>③>①>②
= 3CO2↑+Al(OH)3↓ ④>③>①>②
【解析】
(1)NaHSO4是强酸酸式盐,是强电解质,全部电离;Na2CO3中碳酸根水解。
(2)先表示25℃时溶液的c(H+),在计算![]() 。
。
(3)根据相同浓度的强酸、弱酸分析氢离子浓度;中和NaOH的能力取决于酸的物质的量及几元酸。
(4)根据盐的类型分析水解后溶液显酸碱性。
(5)明矾(K Al(SO4)212H2O)主要是铝离子水解生成氢氧化铝胶体而做净水剂。
(6)泡沫灭火器(硫酸铝和碳酸氢钠溶液)灭火时发生双水解。
(7)根据铵根离子水解及影响分析。
(1)NaHSO4是强酸酸式盐,是强电解质,NaHSO4溶液的电离方程式NaHSO4=Na++H++![]() ;Na2CO3中碳酸根水解,水解的离子方程式
;Na2CO3中碳酸根水解,水解的离子方程式![]() +H2O
+H2O![]()
![]() +OH-;故答案为:NaHSO4=Na++H++
+OH-;故答案为:NaHSO4=Na++H++![]() ;
;![]() +H2O
+H2O![]()
![]() +OH-。
+OH-。
(2)25℃时,pH= a的NaOH溶液中, 溶液的c(H+)=1.0×10amolL1,则![]() ;故答案为:
;故答案为:![]() 。
。
(3)在一定温度下,有a.盐酸 b.硫酸 c.醋酸三种酸:(请用相应字母填)
①当三种酸物质的量浓度相同时,硫酸是二元强酸,全部电离,盐酸是一元强酸,全部电离,醋酸是一元弱酸,部分电离,因此c(H+)由大到小的顺序是b>a>c。
②同体积、同物质的量浓度的三种酸,物质的量相等,硫酸是二元酸,因此消耗NaOH溶液是盐酸的二倍,盐酸消耗的NaOH等于醋酸消耗的NaOH,因此中和NaOH的能力由大到小的顺序是b>a=c;故答案为:b>a=c。
③若三者pH相同且体积相等,醋酸是部分电离,盐酸、硫酸全部电离,三者氢离子物质的量相等,但醋酸的物质的量远大于盐酸和硫酸,因此中和NaOH的能力由大到小的顺序是c>a=b;故答案为:c>a=b。
(4)有下列盐溶液:①MgCl2是强酸弱碱盐,水解呈酸性;②KNO3是强酸强碱盐,呈中性;③KClO是强碱弱酸盐,水解呈碱性;④CH3COONH4是弱酸弱碱盐,但两者水解程度相当,溶液呈中性;⑤NaCN是强碱弱酸盐,水解显碱性;⑥Fe2(SO4)3是强酸弱碱盐,水解显酸性;呈酸性的是①⑥,呈碱性的是③⑤,呈中性的是②④;故答案为:①⑥;③⑤;②④。
(5)明矾(K Al(SO4)212H2O)做净水剂,主要是铝离子水解生成氢氧化铝胶体,其净水时的离子方程式Al3++3H2O![]() Al(OH)3+3H+;故答案为:Al3++3H2O
Al(OH)3+3H+;故答案为:Al3++3H2O![]() Al(OH)3+3H+。
Al(OH)3+3H+。
(6)泡沫灭火器(硫酸铝和碳酸氢钠溶液)灭火时发生双水解生成氢氧化铝沉淀和二氧化碳气体,其发生反应的离子方程式:Al3++3![]() = 3CO2↑+Al(OH)3↓;故答案为:Al3++3
= 3CO2↑+Al(OH)3↓;故答案为:Al3++3![]() = 3CO2↑+Al(OH)3↓。
= 3CO2↑+Al(OH)3↓。
(7)物质的量浓度相同的①氯化铵,铵根单一水解;②碳酸氢铵,铵根、碳酸氢根相互促进的双水解,水解程度比单一水解程度大,铵根离子浓度小;③硫酸氢铵,铵根水解,硫酸氢铵电离出的氢离子抑制铵根水解;④硫酸铵,1mol硫酸铵电离出铵根离子是①②③中电离出铵根离子量的两倍,虽然铵根能够部分水解,但是硫酸铵中铵根浓度比①②③中铵根浓度大,因此4种溶液中c(![]() )由大到小的顺序是④>③>①>②;故答案为:④>③>①>②。
)由大到小的顺序是④>③>①>②;故答案为:④>③>①>②。


 七彩题卡口算应用一点通系列答案
七彩题卡口算应用一点通系列答案科目:高中化学 来源: 题型:
【题目】一定温度下用过量铁块与稀硫酸反应制取氢气,采取下列措施:①将铁块换为等质量的铁粉;②加入少量![]() 溶液;③加入少量
溶液;③加入少量![]() 固体;④加入少量水;⑤加热;⑥将稀硫酸换为98%的硫酸,其中可提高反应速率的措施有
固体;④加入少量水;⑤加热;⑥将稀硫酸换为98%的硫酸,其中可提高反应速率的措施有
A.①③④B.①③⑤C.②④⑤D.②⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式中,属于水解反应的是( )
A.HS- + H2O![]() H3O+ + S2-B.CO2 + 2H2O
H3O+ + S2-B.CO2 + 2H2O![]() HCO3- + H3O+
HCO3- + H3O+
C.NH4++H2O![]() NH3H2O + H+D.HCO3- + OH-
NH3H2O + H+D.HCO3- + OH-![]() CO32- + H2O
CO32- + H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
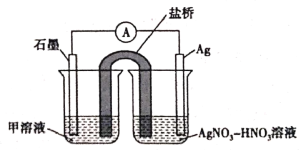
【题目】实验能力和创新意识是化学学科核心素养的重要内容之一。某研究性学习小组在验证反应“ Fe![]() ”的实验中检测到
”的实验中检测到![]() 发现和探究过程如下:向硝酸酸化的
发现和探究过程如下:向硝酸酸化的![]() 硝酸银溶液(
硝酸银溶液(![]() )中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
)中加入过量铁粉,搅拌后静置,烧杯底部有黑色固体,溶液呈黄色。
(1)检验产物:
①检验上层清液中所含离子的方法:取上层清液,滴加_________,产生蓝色沉淀,说明溶液中含有Fe2+。
②经检验黑色固体为Ag,检验方法:取出少量黑色固体,洗涤后,加入适量稀硝酸使固体溶解,再滴加__________(填试剂),产生_________(填现象)。
(2)针对“溶液呈黄色”,甲认为溶液中有![]() 乙认为铁粉过量时不可能有
乙认为铁粉过量时不可能有![]() ,乙依据的原理是______。(用离子方程式表示)o
,乙依据的原理是______。(用离子方程式表示)o
针对这两种观点继续实验:取上层清液,滴加KSCN溶液,溶液变红,证实了甲的猜测。同时发现有白色沉淀产生,且溶液颜色深浅、沉淀量多少与取样时间有关,对比实验记录如下:
序号 | 取样时间/min | 现象 |
I | 3 | 产生大量白色沉淀;溶液呈红色 |
II | 30 | 产生白色沉淀,较3 min时量少;溶液红色较3 min时加深 |
III | 120 | 产生白色沉淀,较30min时量少;溶液红色较30min时变浅 |
(资料: ![]() -生成白色沉淀AgSCN)
-生成白色沉淀AgSCN)
(3)实验中溶液变为红色的离子方程式为_______________,产生白色沉淀说明存在___________(填离子符号)。
(4)对![]() 产生的原因做如下假设:
产生的原因做如下假设:
假设a:可能是铁粉表面有氧化层,能产生![]()
假设b:空气中存在![]() 发生反应
发生反应![]() 产生
产生![]()
假设c:酸性溶液中的NO3-将Fe2+氧化为Fe3+
假设d:溶液存在Ag+将Fe2+氧化为Fe3+
下述实验可证实假设a、b
①实验:向硝酸酸化的__________溶液( ![]() )中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
)中加入过量铁粉,搅拌后静置,不同时间取上层清液滴加KSCN溶液。3min 时溶液呈浅红色,30min后溶液几乎无色。
②实验II的现象说明发生了反应__________(用离子方程式表示)。
(5)实验Ⅱ中发生的反应可以用下列装置来验证。其中甲溶液是___________,分别取电池工作前与工作一段时间后左侧烧杯中溶液,同时滴加KSCN溶液,_______ (“前者”或“后者”)红色更深。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:①101kPa时,2C(s)+O2(g)=2CO(g) ΔH=-221kJ·mol-1
②稀溶液中,H+(aq)+OH-(aq)=H2O(l) ΔH=-57.3kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8kJ·mol-1
④H2O(g)=H2O(l) ΔH=-44.0kJ·mol-1
下列结论正确的是( )
A.碳的燃烧热大于110.5kJ·mol-1
B.浓硫酸与稀NaOH溶液反应生成1mol水,放出57.3kJ 热量
C.氢气的燃烧热为241.8kJ·mol-1
D.2H2(g)+O2(g)=2H2O(l)的反应热为ΔH=571.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚铁氰化钾(K4[Fe(CN)6])又称黄血盐,用于检验Fe3+,也用作实验的防结剂。检验三价铁发生的反应为:K4[Fe(CN)6]+FeCl3=KFe[Fe(CN)6]↓(滕氏蓝)+3KCl,回答问题:
(1)Fe3+的核外电子排布式_________;
(2)与CN-互为等电子体的分子是______,K4[Fe(CN)6]中的作用力除离子键和共价键外,还有_______。含有12mol σ键的K4[Fe(CN)6]的物质的量为_______mol。
(3)黄血盐中C原子的杂化方式为______;C、N、O的第一电离能由大到小的排序为________;
(4)Fe、Na、K的晶体结构如图所示。

①钠的熔点比钾更高,原因是__________;
②Fe原子半径是r cm,阿伏加德罗常数为NA,铁的相对原子质量为a,则铁单质的密度是_____g/cm3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据环保要求,在处理有氰电镀废水时,剧毒的CN-离子在催化剂TiO2颗粒作用下,先用NaClO将CN-离子氧化成CNO-(CN-和CNO-中N元素均为-3价),再在酸性条件下继续与NaClO反应生成N2、CO2和Cl2。环保工作人员在密闭系统中用如图装置进行实验,测定CN-被处理的百分率。

现将浓缩后含CN-离子的污水与过量NaClO溶液的混合液倒入甲中,塞上橡皮塞,一段时间后,打开橡皮塞和活塞,使溶液全部放入乙中,关闭活塞。回答下列问题:
(1)根据题意,写出相关主要反应的离子方程式:甲中的反应_________________,乙中的反应:_____________________。
(2)上述实验是通过测定CO2的量来确定对CN-的处理效果。丙装置中的试剂是______________,丁装置的目的是________________________;干燥管Ⅱ的作用是______________________。
(3)假定上述每一个装置都充分吸收,则利用该装置测得的CN-被处理的百分率与实际值相比_____(填“偏高”或“偏低”),简述可能的原因:______________________。
(4)含氰废水也可采用电化学方法进行处理。在碱性条件下,使用惰性电极电解含氰废水,氰离子被氧化为无毒的物质,其中阳极电极反应式是___________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为测定Na2CO3和NaHCO3固体混合物样品的组成,称取四份质量均为2.96g的固体溶于水,分别往四份溶液中逐滴加入不同体积1.00mol·L-1的盐酸,加入盐酸溶液的体积和收集到CO2气体的体积(忽略气体在水中的溶解,气体体积均已折算成标准状况下的体积)如表所示:
实验序号 | 1 | 2 | 3 | 4 |
盐酸体积/mL | 20 | 40 | 60 | 80 |
CO2体积/mL | 0 | 448 | 672 | 672 |
下列说法不正确的是
A.实验1中发生反应的离子方程式为:CO![]() +H+=HCO
+H+=HCO![]()
B.实验2溶液中,含有NaCl、Na2CO3和NaHCO3三种溶质
C.实验3和实验4蒸干溶液所得固体一定是NaCl
D.原固体混合物中Na2CO3和NaHCO3的物质的量之比为2:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com