
(9分)硫代硫酸钠( Na2S2O3)可用做分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2制得。实验室模拟该工业过程的装置如图所示。
回答下列问题:
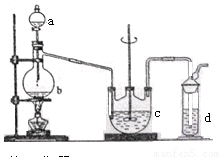
(1)b中反应的离子方程式为__________________,c中试剂为_____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是____________________。
(3)d中的试剂为____________。
(4)实验中要控制SO2生成速率,可以采取的措施有______________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2,不能过量,原因是_______________________。
(1)SO32-+2H+= H2O +SO2↑;或HSO3-+H+=SO2↑+H2O;硫化钠和碳酸钠的混合溶液
(2)硫(3)NaOH溶液 (4)控制反应温度、调节酸的滴加速度(或调节酸的浓度等)
(5)若SO2过量,溶液显酸性,产物分解
【解析】
试题分析:(1)装置b是制取SO2的装置。在b中反应的离子方程式为SO32-+2H+= H2O +SO2↑;或HSO3-+H+=SO2↑+H2O;根据反应原理可知在c中的试剂是硫化钠和碳酸钠的混合溶液。(2)反应开始后,c中先发生反应:H2O+SO2+Na2S=H2S+ Na2SO3; SO2+2H2S=3S↓+ 2H2O.S是不溶于水的淡黄色物质。因此有浑浊产生,后又变澄清,发生反应:2Na2S+Na2CO3+4SO2=3Na2S2O3 +CO2。(3) H2S 、SO2都是大气污染物。由于它们都是酸性气体,能够与碱发生反应,所以在d中的试剂为强碱NaOH溶液。为防止倒吸现象的发生,在导气管的末端安装了一个干燥管。(4)影响化学反应速率的因素的因素有浓度、温度、滴加速度等。在实验中要控制SO2生成速率,可以采取的措施有控制反应温度、调节酸的滴加速度或调节酸的浓度等。(5)硫代硫酸钠( Na2S2O3)是强碱弱酸盐,与酸容易发生反应。所以若SO2过量,溶液显酸性,产物容易分解。因此不能过量。
考点:考查物质的制备原理、反应条件的控制、试剂的选择、现象的描述、方程式的书写的知识。


科目:高中化学 来源:2013-2014北京市朝阳区高三二模理综化学试卷(解析版) 题型:简答题
(14分)
一位同学在复习时遇到这样一道习题:某无色溶液中可能含有“H+、OH-、Na+、NO3-”,加入铝粉后,只产生H2,问该无色溶液中能大量存在哪几种离子。
(1)加入铝粉产生H2,说明铝具有______(填“氧化性”或“还原性”)。
(2)该同学分析:若H+大量存在,则NO3-就不能大量存在。
设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,液面上方呈浅棕色 ⅲ. 试管变热,溶液沸腾 |
① 盐酸溶解Al2O3薄膜的离子方程式是______。
② 根据现象ⅱ,推测溶液中产生了NO,为进一步确认,进行如下实验:
实 验 | 内 容 | 现 象 |
实验1 | 将湿润KI—淀粉试纸置于空气中 | 未变蓝 |
实验2 | 用湿润KI—淀粉试纸检验浅棕色气体 | 试纸变蓝 |
a. 浅棕色气体是______。
b. 实验1的目的是_______。
c. 实验1、2说明反应生成了NO,将生成NO的离子方程式补充完整:
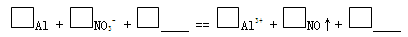
(3)再假设:若OH-大量存在,NO3-也可能不能大量存在。
重新设计实验证实如下:
装 置 | 现 象 |
| ⅰ. 实验初始,未见明显现象 ⅱ. 过一会儿,出现气泡,有刺激性气味 |
为确认“刺激性气味”气体,进行如下实验:用湿润KI—淀粉试纸检验,未变蓝;用湿润红色石蕊试纸检验,试纸变蓝。
① 刺激性气味的气体是______。
② 产生该气体的离子方程式是______。
(4)在NaOH溶液中加入铝粉,结果只检验出有H2生成,其化学方程式是______。
(5)实验结果证实:NO3‑在酸、碱性环境中都有一定的氧化性,能氧化铝单质,产生含氮化合物。习题中的无色溶液一定能大量存在的是Na+和OH-。
查看答案和解析>>
科目:高中化学 来源:2013-2014北京市第二学期期中测试高二化学试卷(解析版) 题型:选择题
能够快速、微量、精确的测定相对分子质量的物理方法是
A.质谱 B.红外光谱 C.现代元素分析法 D.核磁共振氢谱
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:填空题
(15分)铁及其化合物与生产、生活关系密切。
(1)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。
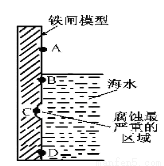
①该电化腐蚀称为 。
②图中A、B、C、D四个区域,生成铁锈最多的是 (填字母)。
(2)用废铁皮制取铁红(Fe2O3)的部分流程示意图如下:
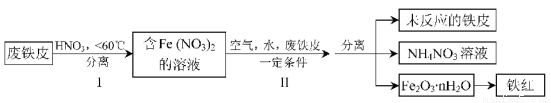
①步骤I若温度过高,将导致硝酸分解。硝酸分解的化学方程式为 。
②步骤Ⅱ中发生反应:4Fe(NO3)2+O2+(2n+4)H2O=2Fe2O3·nH2O+8HNO3,反应产生的HNO3又将废铁皮中的铁转化为Fe(NO3)2,该反应的化学方程式为 。
③上述生产流程中,能体现“绿色化学”思想的是 (任写一项)。
(3)已知t℃时,反应FeO(s)+CO(g) Fe(s)+CO2(g)的平衡常数K=0.25。
Fe(s)+CO2(g)的平衡常数K=0.25。
①t℃时,反应达到平衡时n(CO):n(CO2)= 。
②若在1 L密闭容器中加入0.02 mol FeO(s),并通入xmolCO,t℃时反应达到平衡。此时FeO(s)转化率为50%,则x= 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(福建卷解析版) 题型:选择题
下列关于乙醇的说法不正确的是
A.可用纤维素的水解产物制取 B.可由乙烯通过加成反应制取
C.与乙醛互为同分异构体 D.通过取代反应可制取乙酸乙酯
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(海南卷解析版) 题型:选择题
将BaO2放入密闭的真空容器中,反应2BaO2(s)  2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
2BaO(s)+O2(g)达到平衡。保持温度不变,缩小容器容积,体系重新达到平衡,下列说法正确的是
A.平衡常数减小 B.BaO量不变 C.氧气压强不变 D.BaO2量增加
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(海南卷解析版) 题型:选择题
下列除杂操作可行的是
A.通过浓硫酸除去HCl中的H2O B.通过灼热的CuO除去H2中的CO
C.通过灼热的镁粉除去N2中的O2 D.通过水除去CO中的CO2
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(江苏卷解析版) 题型:填空题
[物质结构与性质]
含有NaOH的Cu(OH)2悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米Cu2O。
(1)Cu+基态核外电子排布式为
(2)与OH-互为等电子体的一种分子为 (填化学式)。
(3)醛基中碳原子的轨道杂化类型是 ;1mol乙醛分子中含有ó的键的数目为 。
(4)含有NaOH的Cu(OH)2悬浊液与乙醛反应的化学方程式为 。
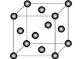
(5)Cu2O在稀硫酸中生成Cu和CuSO4。铜晶胞结构如图所示,铜晶体中每个铜原子周围距离最近的铜原子数目为 。
查看答案和解析>>
科目:高中化学 来源:2014年全国普通高等学校招生统一考试理科综合能力化学(新课标I卷解析版) 题型:选择题
下列有关仪器的使用方法或实验操作正确的是( )
A.洗净的锥形瓶和容量瓶可以放进烘箱中烘干
B.酸式滴定管装标准液前,必须先用该溶液润洗
C.酸碱滴定实验中,用待测溶液润洗锥形瓶以减小实验误差
D.用容量瓶配溶液时,若加水超过刻度线,立即用滴定管吸出多余液体。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com