
分析 (1)根据稀释定律,稀释前后溶质的物质的量不变,据此计算混合溶液中CuSO4和H2SO4的物质的量浓度;
(2)混合后溶液中c(H+)=2c(H2SO4);溶液中硫酸根来源于硫酸铜与硫酸电离,故 c(SO42-)=c(CuSO4)+c(H2SO4).
解答 解:(1)把2.0mol•L-1CuSO4和1.0mol•L-1H2SO4溶液等体积混合,根据稀释定律,稀释前后溶质的物质的量不变,则混合后溶液中c(CuSO4)=$\frac{1}{2}$×2.0mol/L=1.0 mol/L,答:混合溶液中CuSO4的物质的量浓度是1.0mol/L.
(2)混合后n(SO42-)=n(CuSO4)+n(H2SO4)=0.3mol,浓度c=$\frac{0.3mol}{0.2L}$=1.5mol/L.
答:SO42-的物质的量浓度为1.5mol/L.
点评 本题考查物质的量浓度的有关计算,比较基础,注意对公式的理解与灵活运用,注意理解稀释定律.


 灵星计算小达人系列答案
灵星计算小达人系列答案 孟建平错题本系列答案
孟建平错题本系列答案科目:高中化学 来源: 题型:实验题
 用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.
用如图所示装置进行实验.实验过程中,两极均有气体产生,Y极区溶液逐渐变成紫红色;停止实验,铁电极明显变细,电解液仍然澄清.查阅资料发现,高铁酸根(FeO42-)在溶液中呈紫红色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
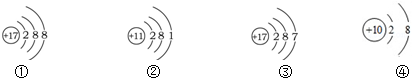
| A. | ①③属于同种元素 | |
| B. | ①属于离子,离子符号为Cl-1 | |
| C. | ①④的化学性质相似 | |
| D. | ②表示的元素在化合物中通常显-1价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加入足量的新制氯水,溶液变色则有Br- | |
| B. | 加入酸性KMn04溶液,观察溶液颜色是否褪去 | |
| C. | 加入少量的碘水,再加入CCl4振荡,有机层有色,则有Br- | |
| D. | 加入足量FeCl3溶液,用CCl4萃取后,在无色的水层中加入氯水,溶液呈橙黄色,则含有Br- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
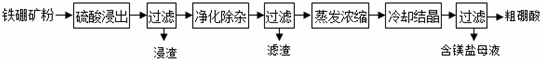
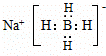 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
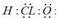
| A. | ①③⑤ | B. | ①②③ | C. | ④⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 46% | B. | 57.5% | C. | 58.4% | D. | 无法计算 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com