
| 反应进程(分钟) | 1 | 2 | 5 | 15 | 20 |
| 3.0mol/L盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
| 1.5mol/L硫酸 | 均无明显现象(无气泡产生) | ||||
| 3.0mol/L硫酸 | 均无明显现象(无气泡产生) | ||||


 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
| A、二氧化硫的水溶液能使紫色石蕊试液变红,说明它能和水反应生成H2SO3 |
| B、二氧化硫能漂白某些物质,说明它具有氧化性 |
| C、将足量二氧化硫通入酸性高锰酸钾试液中,溶液褪色,说明二氧化硫具有还原性 |
| D、实验室可用浓硫酸干燥二氧化硫气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氮化镁的化学式:MgN | ||||
B、中子数为18的氯原子:
| ||||
| C、Ca(OH)2的电离方程式:Ca(OH)2═Ca2++2OH- | ||||
D、铁在氯气中燃烧:2Fe+3Cl2
|
查看答案和解析>>
科目:高中化学 来源: 题型:
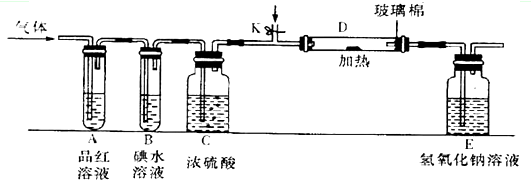
查看答案和解析>>
科目:高中化学 来源: 题型:
| 二氧化锰与氯酸钾的质量比 | 1/40 | 1/20 | 1/10 | 1/5 | 1/3 | 1/2 | 2/3 | 1/1 | 2/1 |
| 生成1L氧气所需的时间(s) | 124 | 79 | 50 | 54 | 75 | 93 | 106 | 153 | 240 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径:Na>O;离子半径:Na+<O2- |
| B、第ⅦA族元素碘的两种核素131I和137I的核外电子数之差为6 |
| C、P和As属于第VA族元素,H3PO4的酸性强于H3AsO4的酸性 |
| D、Na、Mg、Al三种元素最高价氧化物对应水化物的碱性均依次减弱 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com