
硼酸(H3BO3)大量应用于玻璃制造行业,以硼镁矿(2MgO•B2O3•H2O、SiO2及少量Fe3O4、CaCO3、Al2O3)为原料生产硼酸的工艺流程如下:

已知:H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g。Fe3 +、Al3+、Fe2 +和Mg2+以氢氧化物形式完全沉淀时,溶液的pH分别为3. 2、5.2、9.7和12.4。
(1)由于矿粉中含CaCO3,“浸取”时容易产生大量泡沫使物料从反应器溢出,故应分批加入稀硫酸。该反应的化学方程式为 。
(2)“浸出液”显酸性,含H3BO3和Mg2+、SO42-,还含有Fe3 +、Fe2+、Ca2+、Al3+等杂质。“除杂”时向浸出液中依次加入适量H2O2和MgO,除去的杂质离子是 。H2O2的作用是 (用离子方程式表示)。
(3)“浸取”后,采用“热过滤”的目的是 。
(4)“母液”可用于回收硫酸镁,已知硫酸镁的溶解度随温度变化的曲线如下图,且溶液的沸点随压强增大而升高。为了从“母液”中充分回收MgSO4•H2O,应采取的措施是将“母液”蒸发浓缩, 。

32.(16分)
(1)CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑ (3分)
(2)Fe3+、Fe2+、Al3+ (3分,每个1分)
H2O2+2H++2Fe2+=2Fe3++2H2O (3分)
(3)防止温度下降时H3BO3从溶液中析出(意思相同即可给分。例如:从H3BO3溶解度数据可知,温度较高时,H3BO3溶解度较大,不易从溶液中析出。) (3分)
(4)加压升温结晶 (4分,加压、升温结晶各2分)
【解析】
试题分析:(1)由于硫酸的酸性比碳酸强,则矿粉中的碳酸钙与加入的稀硫酸能发生复分解反应,生成硫酸钙、二氧化碳气体和水,即CaCO3(粉末)+H2SO4=CaSO4+H2O+CO2↑,粉末状碳酸钙及分批加入稀硫酸能加快反应速率、防止微溶的硫酸钙覆盖在碳酸钙固体表面阻止反应的顺利进行;根据流程图及题意可知,浸取时2MgO•B2O3•H2O及少量Fe3O4、CaCO3、Al2O3都能溶于稀硫酸,而SiO2不能溶于稀硫酸;(2)双氧水是常用的绿色氧化剂,所含氧元素由—1价降低为—2价,杂质阳离子中只有亚铁离子能被其氧化为铁离子,即H2O2+2H++2Fe2+=2Fe3++2H2O;由于铁离子和铝离子能够水解,即Fe3++3H2O Fe(OH)3+3H+、Al3++3H2O
Fe(OH)3+3H+、Al3++3H2O Al(OH)3+3H+,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即MgO+2H+=Mg2++H2O,减小氢离子浓度,增大溶液pH至3.2时,促进铁离子水解到底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液pH至5.2时,促进铝离子水街到底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是Fe3+、Fe2+、Al3+;(3)浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息,H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时H3BO3从溶液中析出;(4)除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从“母液”中充分回收MgSO4•H2O,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是MgSO4•7H2O晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到MgSO4•H2O晶体。
Al(OH)3+3H+,用稀硫酸浸取及浸出液呈酸性时,能抑制铁离子和铝离子的水解,加入过氧化氢和氧化镁时,能消耗氢离子、生成水且不引入新的杂质阳离子,即MgO+2H+=Mg2++H2O,减小氢离子浓度,增大溶液pH至3.2时,促进铁离子水解到底,即亚铁离子转化为铁离子,铁离子完全沉淀为氢氧化铁,增大溶液pH至5.2时,促进铝离子水街到底,即铝离子完全沉淀为氢氧化铝沉淀,因此加入适量过氧化氢和氧化镁除去的杂质离子是Fe3+、Fe2+、Al3+;(3)浸取时二氧化硅不溶于稀硫酸,浸取反应生成硫酸钙微溶于水,其余物质溶解后变为硼酸、硫酸亚铁、硫酸铁、硫酸镁,根据已知信息,H3BO3在20℃、40℃、60℃、100℃时的溶解度依次为5.0g、8.7g、14.8g、40.2g,为了除去固液混合物中的二氧化硅和硫酸钙,且不能损失硼酸,因此应选择硼酸溶解度最大时的温度,进行趁热过滤,防止温度下降时H3BO3从溶液中析出;(4)除杂时,所得滤渣的主要成分是氢氧化铁、氢氧化铝,而母液的主要成分是硼酸、硫酸镁;为了从“母液”中充分回收MgSO4•H2O,根据硫酸镁的溶解度随温度变化的曲线的已知信息推断,若蒸发浓缩、冷却结晶得到的是MgSO4•7H2O晶体,因此应该蒸发浓缩,升温结晶;根据溶液的沸点随压强增大而升高的已知条件,为了防止蒸发时液体沸腾,影响结晶,还要加压结晶,防止蒸发浓缩时溶液沸腾,从而得到MgSO4•H2O晶体。
考点:考查物质制备化学工艺流程,涉及硫酸和碳酸的酸性、复分解反应、化学方程式、混合物分离与提纯的除杂试剂及原理、根据硼酸的溶解度信息解释热过滤的原因、根据溶解度曲线及压强对溶液沸点的影响选择制备结晶水化合物的措施等。


 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:
 (2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.
(2013?乐山三模)太阳能电池的发展已经进入了第三代.第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池.

查看答案和解析>>
科目:高中化学 来源: 题型:
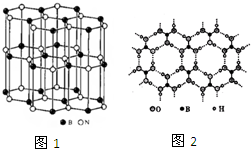 尿素(
尿素(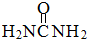 )和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:
)和硼砂(Na2B4O7)在高温高压下反应可以获得硼氮化合物:查看答案和解析>>
科目:高中化学 来源:2014届东北三省四市教研协作体高三联合考试理综化学试卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGs(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)Cu晶体的堆积方式是 (填堆积名称),其配位数为 ;往Cu的硫酸盐溶液中加入过量氨水,可生成[Cu(NH3)4]SO4,下列说法正确的是_____
A.[Cu (NH3)4]SO4中所含的化学键有离子键、极性键和配位键
B.在[Cu(NH3)4 ]2+中Cu2+给出孤对电子,NH3提供空轨道
C.[Cu (NH3)4]SO4组成元素中第一电离能最大的是氧元素
D.SO42-与PO43-互为等电子体,空间构型均为正四面体
(4)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)溶于水显弱酸性,但它却只是一元酸,可以用硼酸在水溶液中的电离平衡解释它只是一元弱酸的原因。
①H3BO3中B的原子杂化类型为 ;
②写出硼酸在水溶液中的电离方程式 。
(5)硅与碳是同一主族元素,其中石墨为混合型晶体,已知石墨的层 间距为335pm,C-C键长为142pm,计算石墨晶体密度(要求写出计算过程,得出结果保留三位有效数字,NA为6.02×1023mol-1)

查看答案和解析>>
科目:高中化学 来源:2012-2013学年江苏省泰州市高三上学期期末考试化学试卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺入Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)亚铜离子(Cu+)基态时的价电子排布式表示为 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]-而体现一元弱酸的性质。
①[B(OH)4]-中B的原子杂化类型为 ;
②不考虑空间构型,[B(OH)4]-的结构可用示意图表示为 。
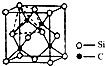
(4)单晶硅的结构与金刚石结构相似,若将金刚石晶体中一半的C原子换成Si原子且同种原子不成键,则得右图所示的金刚砂(SiC)结构;若在晶体硅所有Si—Si键中插入O原子即得SiO2晶体。

①在SiC中,每个C原子周围最近的C原子数目为 ;
②判断a. SiO2,b.干冰,c.冰3种晶体的熔点从小到大的顺序是 (填序号)。
查看答案和解析>>
科目:高中化学 来源:2012-2013学年江西省南昌市高三第三次模拟考试理综化学试卷(解析版) 题型:填空题
太阳能电池的发展已经进入了第三代。第一代为单晶硅太阳能电池,第二代为多晶硅、非晶硅等太阳能电池,第三代就是铜铟镓硒CIGS(CIS中掺人Ga)等化合物薄膜太阳能电池以及薄膜Si系太阳能电池。
(1)镓的基态原子的电子排布式是___ 。
(2)硒为第4周期元素,相邻的元素有砷和溴,则3种元素的第一电离能从大到小顺序为 (用元素符号表示)。
(3)H2Se的酸性比H2S____(填“强”或“弱”)。气态SeO3分子的立体构型为____ 。
(4)硅烷(SinH2n+2)的沸点与其相对分子质量的变化关系如图所示,呈现这种变化关系的原因是 。

(5)与镓元素处于同一主族的硼元素具有缺电子性,其化合物往往具有加合性,因而硼酸(H3BO3)在水溶液中能与水反应生成[B(OH)4]—而体现一元弱酸的性质,则[B(OH)4]—中B的原子杂化类型为 。
(6)金属Cu单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,其原因是____,反应的离子方程式为 。
(7)一种铜金合金晶体具有面心立方最密堆积的结构。在晶脆中,Au原子位于顶点,Cu原子位于面心,则该合金中Au原子与Cu原子个数之比为 ,若该晶胞的边长为a pm,则合金的密度为 g·cm-3(已知lpm=10-12m,只要求列算式,不必计算出数值,阿伏加塞罗常数为NA)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com