
【题目】(1)已知有机物A的分子式为C5H11Br,且不能发生消去反应,则A的结构简式为_______;
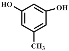
(2)已知有机物A的分子式为C7H8O2,有机物A的结构有多种:若A可与FeCl3溶液发生显色反应,且1 mol的A可与2 mol的Na2CO3反应,则A共有______种,其中核磁共振氢谱为四组峰,峰面积比为3∶2∶2∶1的结构有两种,它们的结构简式分别为___________、____________。
(3)已知烯烃能被酸性KMnO4溶液氧化,![]()
1mol的某烃A完全燃烧生成5molCO2和4molH2O,则A的分子式为_____,若该烃用酸性KMnO4溶液氧化后得到HOOCCH2CH2CH2COOH,由此推断该烃的结构的结构简式:__________;若A的一氯代物只有一种,则A的结构简式为____________。
【答案】![]() 6
6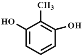
 C5H8
C5H8![]()
![]()
【解析】
(1)C5H11Br不能发生消去反应,则与Br原子相连的碳原子相邻的C原子上没有H原子,其结构简式为: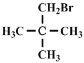 ,故答案为:
,故答案为: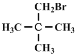 ;
;
(2)若A可与FeCl3溶液发生显色反应,说明分子中含有酚羟基,且1 mol的A可与2 mol的Na2CO3反应,说明分子中含有两个酚羟基,两个酚羟基在苯环上的排列有邻、间、对三种结构,然后再变换甲基的位置,共有6种不同的结构;其中核磁共振氢谱为四组峰,说明分子中含有四种氢,峰面积比为3∶2∶2∶1的结构简式为: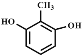 或
或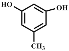 ,故答案为:6、
,故答案为:6、  、
、 ;
;
(3) 1mol的某烃A完全燃烧生成5molCO2和4molH2O,说明A分子含有5个碳原子和8个氢原子,其分子式为:C5H8,该烃用酸性KMnO4溶液氧化后得到HOOCCH2CH2CH2COOH,产物只有一种,说明分子结构中含有环状结构,结构简式为:![]() ;若A的一氯代物只有一种,则A分子中8个氢原子所处的化学环境是相同的,结构简式为:
;若A的一氯代物只有一种,则A分子中8个氢原子所处的化学环境是相同的,结构简式为:![]() 。
。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】(1)在某一容积为2 L的密闭容器中,某一反应中A、B、C、D四种气体的物质的量n(mol)随时间t(min)的变化曲线如图所示:

回答下列问题:
①该反应的化学方程式为__________________________________。
②前2 min用A的浓度变化表示的化学反应速率为________。在2 min时,图像发生改变的原因是________(填字母)。
A.增大压强 B.降低温度 C.加入催化剂 D.增加A的物质的量
(2)在100 ℃时,将0.01 mol的四氧化二氮气体充入0.1 L的密闭容器中发生反应,隔一定时间对该容器内的物质进行分析,得到如下表格:
时间/s 浓度/mol·L-1 | 0 | 20 | 40 | 60 | 80 | 100 |
c(N2O4)/mol·L-1 | 0.100 | 0.070 | 0.050 | c3 | a | b |
c(NO2)/mol·L-1 | 0.000 | 0.060 | c2 | 0.120 | 0.120 | 0.120 |
试填空:
①该反应的化学方程式________________________________,达到平衡时四氧化二氮的转化率为_______。
②在0~20 s内,四氧化二氮的平均反应速率为______,哪一时间段______(指0~20、20~40、40~60、60~80、80~100 s)反应速率最大并解释______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】勒夏特列原理在生产生活中有许多重要应用。完成下列填空:
(1)实验室配置FeCl3溶液时,将FeCl3溶解在盐酸中,目的是防止________________________。
(2)石蕊(用HZ表示)试液中存在的电离平衡HZ(红色)![]() H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
H++Z—(蓝色)。在中性溶液中。石蕊试液呈__________色;要使石蕊试液呈红色,可加入____________________________。
(3)工业制硫酸时,为使SO2尽可能多地转化成SO3,采取的措施是_______________________。
(4)合成氨工业采取的以下措施中,可以用勒夏特列原理解释的是_________(选填编号)。
a.升温至500℃左右 b.使用催化剂
c.加压至20~50MPA. d.将氨及时液化分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】As的原子结构示意图为![]() ,下列关于As的描述不正确的是 ( )
,下列关于As的描述不正确的是 ( )
A. 位于第四周期,第ⅤA族 B. 属于非金属元素
C. 酸性:H3AsO4﹥H3PO4 D. 稳定性:AsH3﹤PH3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期金属元素A~E在元素周期表中的相对位置如表所示,下面判断正确的是( )

A. 氢氧化物的化学式及其碱性:COH>D(OH)2>E(OH)3
B. 金属性:A>C
C. 原子半径:C<D<E
D. 最外层电子数:A>B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的措施是( )
A. 向水中通入SO2 B. 将水加热煮沸
C. 向纯水中投入一小块金属钠 D. 向水中加入NaCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:一定条件下。向A、B两个恒容密闭容器中分别加入等量的X,发生反应2X(g)![]() 2y(g)+z(g)测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法不正确的是( )
2y(g)+z(g)测得A、B容器中X的物质的量n(X)随时间t的变化如图所示。下列说法不正确的是( )

A. 若A、B容积相同,但反应温度不同,且温度:A>B
B. 若A、B反应温度相同,但容积不同,且容积:A<B
C. a,c两点对应的平均相对分子质量:a>c
D. t1t2时间段内,A、B两容器中平均反应速率相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大危害,必须进行处理.常用的处理方法有两种.方法1:还原沉淀法.
该法的工艺流程为:
其中第①步存在平衡2CrO42(黄色)+2H+Cr2O32(橙色)+H2O
(1)若平衡体系的pH=2,该溶液显______色.
(2)能说明第①步反应达平衡状态的是_____(填序号)
A.Cr2O72和CrO42的浓度相同
B.2v(Cr2O72)=v(CrO42)
C.溶液的颜色不变
(3)第②步中,还原1molCr2O72离子,需要______mol的FeSO47H2O.
(4)第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s)Cr3+(aq)+3OH-(aq),常温下,Cr(OH)3的溶度积Ksp=c(Cr3+)c3(OH-)=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至______.
方法2:电解法.
该法用Fe做电极电解含Cr2O72的酸性废水,随着电解的进行,在阴极附近溶液pH升高,产生
Cr(OH)3沉淀.
(5)用Fe做电极的原因为______(用电极反应式解释).
(6)在阴极附近溶液pH升高,溶液中同时生成的沉淀还有______.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com