
 .
. 科目:高中化学 来源: 题型:选择题
| A. | 石墨的能量比金刚石低 | B. | 石墨和金刚石都是碳的同位素 | ||
| C. | 金刚石转化为石墨是物理变化 | D. | 金刚石比石墨更稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 聚2一乙烯吡啶的复合物与有机物性质相似,因此聚2一乙烯吡啶的复合物不会导电 | |
| B. | 正极的反应为P2VP•nI2+2Li++2e-═P2VP•(n-1)I2+2LiI | |
| C. | 电池工作时,碘离子移向P2VP一极 | |
| D. | 该电池所产生的电压低,使用寿命比较短 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅤⅡA | 0 |
| 二 | ① | ② | ||||||
| 三 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 四 | ⑨ | ⑩ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
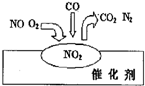
| A. | NO2是该过程的最终产物 | |
| B. | NO和O2必须在催化剂表面才能反应 | |
| C. | 汽车尾气的主要污染成分是CO2和NO | |
| D. | 该催化转化的总反应方程式为:2NO+O2+4CO$\frac{\underline{\;催化剂\;}}{\;}$ 4CO2+N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、HCO3-、SO42- | B. | K+、Cu2+、Cl-、NO3- | ||
| C. | NH4+、Al3+、Br-、SO42- | D. | Na+、Ba2+、Cl-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 砹为有色固体 | |
| B. | HAt 很稳定 | |
| C. | AgAt易溶于水 | |
| D. | 砹单质的熔沸点比碘单质的熔沸点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
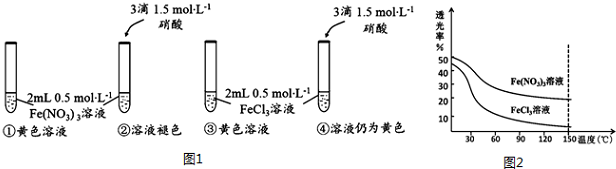
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com