
| A. | 测定沸点 | B. | 测静电对液流影响 | ||
| C. | 测定蒸气密度 | D. | 测标准状况下气体摩尔体积 |
科目:高中化学 来源: 题型:选择题
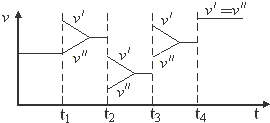
| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
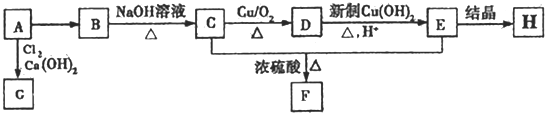
 .
.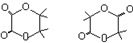 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 晶体 | NaCl | KCl | CaO |
| 晶格能/(Kj.mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用纯碱吸收硫酸工业的尾气 | B. | 用烧碱吸收氯碱工业的尾气 | ||
| C. | 用纯碱吸收合成氨工业的尾气 | D. | 用烧碱吸收炼铁工业的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应①中还原产物只有SO2 | |
| B. | 反应②中Cu2S只发生了氧化反应 | |
| C. | 将1 molCu2S冶炼成 2mol Cu,需要O21mol | |
| D. | 若1molCu2S完全转化为2molCu,则转移电子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
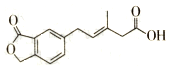
| A. | M可以发生加成、加聚、水解、酯化等反应 | |
| B. | l mol M最多可以与3 mol NaOH反应 | |
| C. | M苯环上的一氯取代物有两种不同结构 | |
| D. | l molM最多可以与5 mol H2发生加成反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com