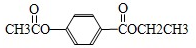
考点:氧化还原反应方程式的配平
专题:氧化还原反应专题
分析:(1)该反应中Mn元素化合价由+7价变为+2价、部分Cl元素化合价由-1价变为0价、部分Cl元素化合价不变,其转移电子总数为10,再结合原子守恒配平方程式;
(2)该反应中P元素化合价由0价变为+5价,Cu元素化合价由+2价变为0价,根据化合价的升降相等,则P的计量数是2,CuSO4的计量数是5,再结合原子守恒配平方程式;
(3)该反应中Mn元素化合价由+7价变为+2价,N元素化合价由+3价变为+5价,根据化合价的升降相等,则KMnO4的计量数是2,KNO2的计量数是5,根据Mn原子守恒,MnSO4的计量数为2,由于生成物中有MnSO4,所以反应物有H2S04,其计量数为3;
(4)在反应中Pt元素的化合价变化为0→+4,N元素的化合价变化为+5→+2,故Pt的计量数是3,HNO3的计量数是4,然后再根据原子守恒配氢和氧元素;
(5)Mn元素的化合价由+7降到+2,降低5价;Fe元素的化合价由+2升高到+3价,升高1价,最小公倍数为5;再根据质量守恒得到H2O的系数为4,H+的系数为8.
解答:
解:(1)该反应中Mn元素化合价由+7价变为+2价,部分Cl元素化合价由-1价变为0价,部分Cl元素化合价不变,根据元素守恒知KCl转移电子总数为10,则MnCl2的计量数是2,Cl2的计量数是5,再结合原子守恒配平方程式为2KMnO4+16HCl=2MnCl2+5Cl2↑+2KCl+8H2O;
故答案为:2、16、2、2、5、8;
(2)该反应中P元素化合价由0价变为+5价,Cu元素化合价由+2价变为0价,根据化合价的升降相等,则P的计量数是2,CuSO4的计量数是5,再结合原子守恒配平方程式为2P+5CuSO4+8H2O═2Cu+2H3PO4+5H2S04;
故答案为:2、5、8、2、2、5;
(3)该反应中Mn元素化合价由+7价变为+2价,N元素化合价由+3价变为+5价,根据化合价的升降相等,则KMnO4的计量数是2,KNO2的计量数是5,根据Mn原子守恒,MnSO4的计量数为2,由于生成物中有MnSO4,所以反应物有H2S04,其计量数为3,再结合原子守恒配平方程式为2KMnO4+5KNO2+3H2SO4=2MnSO4+5KNO3+K2SO4+3H2O;
2、5、3H2S04、2、5、1K2SO4、3;
(4)在反应中Pt元素的化合价变化为0→+4,N元素的化合价变化为+5→+2,故Pt的计量数是3,HNO3的计量数是4,然后再根据原子守恒配氢和氧元素,得反应方程式3Pt+4HNO3+18HCl═3H2PtCl6+4NO↑+8H2O;
故答案为:3、4、18、3、4、8H2O;
(5)Mn元素的化合价由+7降到+2,降低5价;Fe元素的化合价由+2升高到+3价,升高1价,最小公倍数为5;再根据质量守恒得到H2O的系数为4,H+的系数为8.配平方程式为MnO4-+5Fe2++8H+═Mn2++5Fe3++4H2O.
故答案为:1、5、8、1、5、4.
点评:本题考查氧化还原反应,为高频考点,把握反应中元素的化合价变化为解答的关键,侧重氧化还原反应基本概念的考查,注意从元素化合价角度分析,题目难度不大.