
| A. | PM2.5是指大气中直径小于或等于2.5微米的颗粒物,也称为可入肺颗粒物 | |
| B. | PM2.5只是地球大气成分中含量很少的组分,对空气质量和能见度等没什么影响 | |
| C. | PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远 | |
| D. | PM2.5主要来自化石燃料的燃烧(如机动车尾气、燃煤)、挥发性有机物等 |
分析 PM2.5是指大气中直径小于或等于2.5微粒的颗粒物,也称为可入肺颗粒物.PM2.5粒径小,富含大量的有毒、有害物质且在大气中的停留时间长、输送距离远,因而对人体健康和大气环境质量的影响更大,主要来自化石燃料的燃烧(如机动车尾气、燃煤).
解答 解:A.PM2.5也称为可入肺颗粒物,故A正确;
B.PM2.5对空气质量和能见度等影响很大,故B错误;
C.PM2.5粒径小,有毒、有害物质在大气中的停留时间长、输送距离远,故C正确;
D.主要来自化石燃料的燃烧主要来自化石燃料的燃烧、挥发性有机物等,故D正确.
故选B.
点评 本题考查环境污染及治理,侧重于化学与人体健康的考查,为高考常见题型和高频考点,有利于培养学生的良好科学素养,难度不大,注意相关基础知识的积累.


 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案 津桥教育暑假拔高衔接广东人民出版社系列答案
津桥教育暑假拔高衔接广东人民出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 催化剂V2O5不改变该反应的逆反应速率 | |
| B. | 当v(SO2):v(O2):v(SO3 )=2:1:2时,反应达到平衡状态 | |
| C. | 该反应是放热反应,降低温度将缩短反应达到平衡的时间 | |
| D. | 在t1、t2时刻,SO3(g)的浓度分别是c1、c2,则时间间隔t1~t2内,SO3(g)生成的平均反应速率为v=$\frac{{c}_{2}-{c}_{1}}{{t}_{2}-{t}_{1}}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
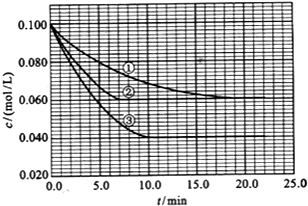 在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:
在溶液中,反应A(g)+2B(g)?C(g)分别在三种不同实验条件下进行,它们的起始浓度均为 c(A)=0.100mol/L、c(B)=0.200mol/L及c(C)=0mol/L.反应物A的浓度随时间的变化如图所示.请回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 17gNH3含有10nA个质子 | |
| B. | 标准状况下,22.4L氯水含有nA个Cl2分子 | |
| C. | 1mol C2H6含有6nA个共价键 | |
| D. | 1mol 金属K被完全氧化生成KO2,失去2nA个电子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 室温下,1LpH=13的NaOH溶液中,由水电离的OH-离子数目为0.1NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 一定条件下2 mol SO2和1 mol O2充分反应后,混合气体的分子总数大于2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al是不活泼的金属,故铝可制成铝箔包装物品 | |
| B. | NaHCO3能与碱反应,故NaHCO3可以用于制作糕点 | |
| C. | NH3能与Cl2生成NH4Cl,故可用浓氨水检验输送氯气的管道是否有泄漏 | |
| D. | 明矾与K2FeO4都能与水生成胶体,均可用于水的净化、杀菌和消毒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性:HClO4<HBrO4<HIO4 | B. | 碱性:NaOH>Mg(OH)2>Al(OH)3 | ||
| C. | 稳定性:HCl<H2S<PH3 | D. | 还原性:Cl->Br->I- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com