
| A. | 标准状况下,0.1molCl2溶于足量NaOH溶液,转移的电子数目为0.1NA | |
| B. | 0.2mol/LCaCl2溶液中含有Cl-离子的数目为0.4NA | |
| C. | 标准状况下,11.2lCCl4中含有分子的数目为0.5NA | |
| D. | 常温常压下,2.24LCO和CO2混合气体中含有的碳原子数目0.1NA |
分析 A、氯气和碱的反应为歧化反应;
B、溶液体积不明确;
C、标况下四氯化碳为液体;
D、常温常压下气体摩尔体积大于22.4L/mol.
解答 解:A、氯气和碱的反应为歧化反应,故0.1mol氯气转移0.1NA个电子,故A正确;
B、溶液体积不明确,故溶液中的氯离子的个数无法计算,故B错误;
C、标况下四氯化碳为液体,故不能根据气体摩尔体积来计算其物质的量,故C错误;
D、常温常压下气体摩尔体积大于22.4L/mol,故2.24L混合气体的物质的量小于0.1mol,则含有的碳原子个数小于0.1NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,难度不大,应注意掌握公式的运用和物质的结构.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:推断题
 有A、B是钠的两种常见的化合物的混合物,其相互转化关系如图(其他略去)
有A、B是钠的两种常见的化合物的混合物,其相互转化关系如图(其他略去)查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 150L2mol•L-1NaCl溶液 | B. | 70.5L0.5mol•L-1CaCl2溶液 | ||
| C. | 150L2mol•L-1KCl溶液 | D. | 75L2mol•L-1AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用湿润的蓝色石蕊试纸检验氨气 | |
| B. | 当浓氨水与浓硫酸反应会产生白烟 | |
| C. | 只用BaCl2溶液就可以鉴别SO42-和CO32- | |
| D. | 在化学实验中,点燃可燃性气体均需要验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①③ | B. | ④② | C. | ③② | D. | ③① |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
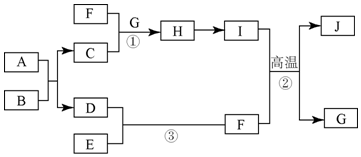
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl2水置于棕色试剂瓶避光保存 | |
| B. | 盛NaOH溶液的试剂瓶用磨口玻璃塞 | |
| C. | FeSO4溶液存放在加有少量铁粉的试剂瓶中 | |
| D. | 区别溶液和胶体的最简单的方法是丁达尔效应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

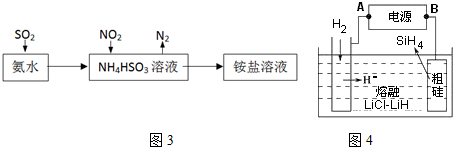
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com