
| A. | 1.5 mol | B. | 5.5 mol | C. | 3 mol | D. | 2.5 mol |
分析 反应中Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.再分析电子得失数目发现,6mol被氧化的P共失电子30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为3mol,则1molCuSO4氧化P0.2mol,由此分析解答.
解答 解:首先分析反应中各元素的化合价变化,Cu的价态由+2→+1(还原),11molP元素中6mol化合价升高(氧化)、5mol化合价降低(还原),可见被氧化的6molP,是被Cu(+2)和另一部分P共同氧化的.
由电子得失数目可知,6mol被氧化的P共失电子6mol×5=30mol,其中Cu(+2)得15mol,另一部分P得另15mol.即15molCuSO4所氧化的P为$\frac{15}{5}$=3mol,故选:C.
点评 本题考查氧化还原反应基本概念与计算,难度中等,关键根据化合价判断氧化剂与还原剂,可以直接利用Cu(+2)得电子等于CuSO4氧化的磷得电子数守恒计算,更为简单.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:
如图所示的装置,X、Y都是惰性电极.将电源接通后,向(甲)中滴入酚酞溶液此空不填,在Fe极附近显红色.丙池中盛有100mL3.00mol•L-1的CuSO4溶液.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:推断题
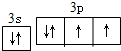 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
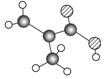 某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验要求 | 选项的标号 |
| (1)证明粗盐中含有少量CaCl2 | |
| (2)鉴别Na2SO4溶液和NaCl溶液 | |
| (3)检验氯化亚铁是否变质 | |
| (4)证明某地雨水溶液呈酸性 | |
| (5)除去FeCl2溶液中的少量FeCl3 | 1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业上增大压强以提高反应物的转化率 | |
| B. | 过氧化氢分解加二氧化锰作催化剂,使单位时间内产生的氧气的量多 | |
| C. | 反应CO(g)+NO2(g)═CO2(g)+NO(g)(正反应为放热反应),达平衡后,升高温度体系颜色变深 | |
| D. | 黄绿色的氯水光照后颜色变浅 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
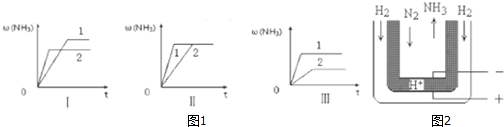
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com