
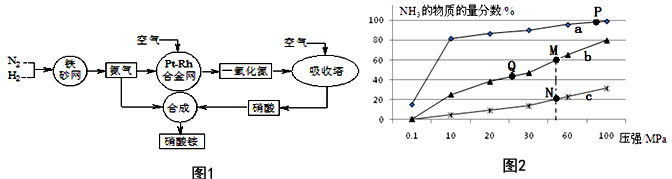
分析 (1)硝酸铵溶液中铵根离子水解,使溶液呈酸性;
(2)①正反应是放热反应,升高温度平衡逆向移动,氨气的含量减小;
②A.减小生成物浓度平衡正向移动;
B.P点原料气的平衡转化率接近100%,但此时压强为100MPa,高压对设备的要求太高,导致成本高,不是当前工业生产工艺中采用的温度、压强条件;
C.K只受温度影响,温度不变平衡常数不变,正反应为放热反应,升高温度平衡逆向移动,平衡常数减小;
D.温度越高反应速率越快;
E.计算平衡时各组分浓度,代入K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})×c{\;}^{3}(H{\;}_{2})}$计算平衡常数;
(3)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;
根据盖斯定律,①+②可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s);
(4)①已知总反应的快慢由慢的一步决定,反应快慢可以依据第一步和第二步反应的曲线斜率比较大小;
②第二步反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大;
(5)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气,电解时,阳极上发生氧化反应得到氧化产物,即为氮气,据此书写电极反应式;
解答 解:(1)硝酸铵溶液中铵根离子水解,会使溶液呈酸性,所以溶液中离子浓度大小关系是c(NO3-)>c(NH4+)>c(H+)>c(OH-),
故答案为:酸性;c(NO3-)>c(NH4+)>c(H+)>c(OH-);
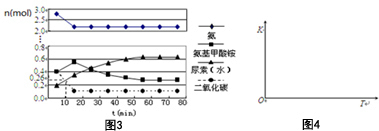
(2)①合成氨的反应为放热反应,反应温度越高,越不利于反应正向进行,曲线a的氨气的物质的量分数最高,其反应温度对应相对最低,所以a曲线对应温度为200°C;
故答案为:200℃;
②A.及时分离出NH3,可以使平衡正向进行,可以提高H2的平衡转化率,故A正确;
B.P点原料气的平衡转化率接近100%,但此时压强为100MPa,高压对设备的要求太高,导致成本高,当前工业生产工艺中采用的500℃、20MPa~50MPa,故B错误;
C.平衡常数与温度有关,与其他条件无关,温度相同时平衡常数相同,反应是放热反应,温度越高平衡常数越小,则M、N、Q点平衡常数K的大小关系是K(M)=K(Q)>K(N),故C正确;
D.N点温度高于M点,温度越低反应速率越快,故N点比M点的反应速率快,故D错误;
E.N点时c(NH3)=0.2mol•L-1,氨气体积分数为20%,则:
N2(g)+3H2(g)?2NH3(g)
起始浓度(mol/L):x 3x 0
变化浓度(mol/L):0.1 0.3 0.2
平衡浓度(mol/L):x-0.1 3x-0.3 0.2
所以$\frac{0.2}{4x-0.2}$=20%,解得x=0.3,平衡常数K=$\frac{c{\;}^{2}(NH{\;}_{3})}{c(N{\;}_{2})×c{\;}^{3}(H{\;}_{2})}$=$\frac{0.{2}^{2}}{0.2×0.{6}^{3}}$≈0.93,故E正确,
故选:ACE;
(3)已知:①2NH3(g)+CO2(g)═H2NCOONH4(s)△H=-272kJ•mol-1;
②H2NCOONH4(s)═CO(NH2)2(s)+H2O(g)△H=+138kJ•mol-1;
根据盖斯定律,①+②可得:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol,
故答案为:2NH3(g)+CO2(g)?H2O(g)+CO(NH2)2 (s)△H=-134kJ/mol;
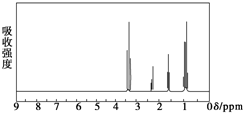
(4)①由图象可知在15分钟左右,氨气和二氧化碳反应生成氨基甲酸铵后不再变化发生的是第一步反应,氨基甲酸铵先增大再减小最后达到平衡,发生的是第二步反应,从曲线斜率不难看出第二步反应速率慢,所以合成尿素总反应的快慢由第二步反应决定,根据图可知,尿素在55分钟时,物质的量不再变化,即反应达到平衡,所以总反应进行到55min时到达平衡,
故答案为:二;55;
②第二步反应为吸热反应,升高温度平衡向正反应方向移动,平衡常数增大,所以第二步反应的平衡常数K随温度的变化的示意图为 ,
,
故答案为: ;
;
(5)电解尿素[CO(NH2)2]的碱性溶液制纯净氢气的过程中同时产生氮气,电解时,阳极上发生氧化反应得到氧化产物,即为氮气,电极反应式为CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O,
故答案为:CO(NH2)2+8OH--6e-=CO32-+N2↑+6H2O.
点评 本题考查化学平衡计算与影响因素、化学平衡图象、热化学方程式的书写、盐类水解等,试题知识点较多、综合性较强,充分考查了学生的分析、理解能力及化学计算能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 甲基橙呈红色的溶液中:Fe2+、Cl-、NO3-、Na+ | |
| B. | 石蕊呈蓝色的溶液中:K+、AlO2-、SiO32-、HSO3- | |
| C. | 含大量Al3+的溶液中:K+、Ca2+、NO3-、HCO3- | |
| D. | 含大量OH一的溶液中:CO32-、ClO3-、F-、K+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化性:Fe3+>Cu2+ | B. | 还原性:Br->Cl- | ||
| C. | 碱性:NaOH>Mg(OH)2 | D. | 酸性:H2SO4>H3PO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的核磁共振氢谱如图所示.则可能是下列物质中的( )
核磁共振氢谱是指有机物分子中的氢原子核所处的化学环境(即其附近的基团)不同,表现出的核磁性就不同,代表核磁性特征的峰在核磁共振图中坐标的位置(化学位移,符号为δ)也就不同.现有一物质的核磁共振氢谱如图所示.则可能是下列物质中的( )| A. | CH3CH2CH3 | B. | CH3CH2CH2OH | C. |  | D. | CH3CH2CHO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二氧化硫有漂白性,常用作棉、麻、纸张和食品的漂白 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5微粒均具有丁达尔效应 | |
| C. | 氯水属于混合物,而液氨、冰醋酸均属于纯净物 | |
| D. | SiO2既能和NaOH溶液反应又能和氢氟酸反应,所以是两性氧化物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com