
只由两种元素组成的化合物,其中一种是氢元素,这类化合物称为氢化物。下列物质不属于氢化物的是( )
A.H2O B.NH3 C.H2SO4 D.NaH
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:实验题
有A、B、C、D、E五种常见化合物,都是由下表中的离子形成的:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42﹣ HCO3﹣ NO3﹣ OH﹣ |
为了鉴别上述化合物。分别完成以下实验,其结果是:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;
②将E 溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;
③进行焰色反应,只有B为紫色(透过蓝色钴玻璃);
④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;
⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)写出B、D的化学式:B ,D 。
(2)将含1mol A的溶液与含1m ol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
ol E的溶液反应后蒸干,仅得到一种化合物,该化合物的化学式为 。
(3)在A溶液中加少入量澄清石灰水,其离子方程式为 。
(4)C常用作净水剂,用离子方程式表示其净水原理 。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
NA表示阿伏加德罗常数,下列说法正确的是
A.在常温常压下,11.2 LN2含有的分子数为0.5 NA
B.71gCl2所含原子数为NA
C.在常温常压下,1molNe含有的原子数为NA
D.在同温、同压下,相同体积的任何气体单质所含的原子数相同
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高一上10月月考化学试卷(解析版) 题型:选择题
科学家 用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米级镊子具有相同数量级的是 ( )
用DNA制造出一种臂长只有7nm的纳米级镊子,这种镊子能钳起分子或原子,并对它们随意组合。下列分散系中分散质的微粒直径与纳米级镊子具有相同数量级的是 ( )
A.溶液 B.胶体 C.悬浊液 D.乳浊液
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:填空题
研究表明,化学反应的能量变化(ΔH)与反应物和生成物的键能有关。键能可以简单的理解为断开1 mol 化学键时所需吸收的能量。下表是部分化学键的键能数据:
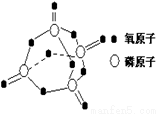
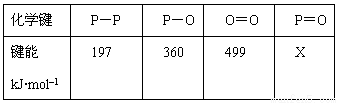
已知白磷的燃烧热为2378.0 kJ/mol,白磷完全燃烧的产物结构如图所示,则上表中X= kJ·mol–1。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省高二上第一次学段考试化学卷(解析版) 题型:选择题
下列与化学反应能量变化相关的叙述正确的是( )
A.反应物总能量低于生成物总能量时,该反应一定不能发生
B.化学键的键能越大,物质的能量越高
C.一个反应的焓变因反应物的用量和反应条件的改变而发生改变
D.应用盖斯定律,可计算某些难以直接测量的反应焓变
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
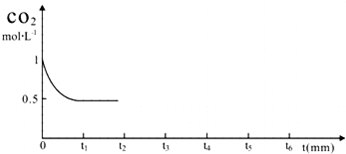
| 反应时间 | CO2(mol) | H2(mol) | CH3OH(mol) | H2O(mol) | |
| 反应I 恒温恒容 | 0min | 2 | 6 | 0 | 0 |
| 10min | 4.5 | ||||
| 20min | 1 | ||||
| 30min | 1 | ||||
| 反应II 绝热恒容 | 0min | 0 | 0 | 2 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
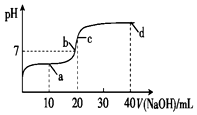 室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )
室温时,向20mL 0.1mol•L-1一元酸HA溶液中滴入0.1mol•L-1的NaOH溶液,溶液的pH变化曲线如图所示.下列说法正确的是( )| A. | a点:c(HA)>c(A-) | B. | b点:c(Na+)=c(A-)+c(HA) | ||
| C. | c点:c(H+)+c(HA)=c(OH-) | D. | d点:c(Na+)>c(A-)>c(OH-)>c(H+) |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com