

分析 A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,说明B是碱,焰色反应呈黄色,说明含有钠元素,所以B是NaOH,根据元素守恒知A是Na,E是H2;
氢气在氯气中燃烧生成HCl,则F是HCl,氢氧化钠溶液和C反应生成D,D、F相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl,结合物质的性质分析解答.
解答 解:A是一种金属,该金属能和水反应生成溶液B和气体E,B溶液能使酚酞试液变红,说明B是碱,焰色反应呈黄色,说明含有钠元素,所以B是NaOH,根据元素守恒知A是Na,E是H2;
氢气在氯气中燃烧生成HCl,则F是HCl,氢氧化钠溶液和C反应生成D,D、F相遇会产生白烟,氯化氢和氨气反应生成白烟氯化铵,则D是NH3,C是NH4Cl,
(1)在加热条件下,氯化铵和氢氧化钠反应生成氯化钠、氨气和水,反应方程式为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O,
故答案为:NaOH+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$NaCl+NH3↑+H2O;
(2)HCl极易溶于水生成盐酸,所以氯化氢在空气中遇水蒸气生成盐酸小液滴而产生白雾,
故答案为:盐酸小液滴.
点评 本题考查了无机物的推断,根据氨气和浓盐酸反应特征、钠焰色反应特征来分析解答即可,明确实验室制取氨气的方法,及氨气的检验方法,难度不大,注意烟和雾的区别.


 世纪百通期末金卷系列答案
世纪百通期末金卷系列答案科目:高中化学 来源: 题型:填空题
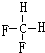 和
和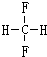
 和CH2=CH-CH2
和CH2=CH-CH2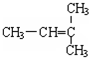 和
和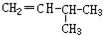
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 说法正确的是( )
说法正确的是( )| A. | 1 molA能与4 mol Ag(NH3)2OH溶液发生银镜反应 | |
| B. | 核磁共振氢谱图显示有三个吸收峰 | |
| C. | 不能与FeCl3溶液发生显色反应 | |
| D. | 1 mol A能与2 mol NaHCO3完全反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
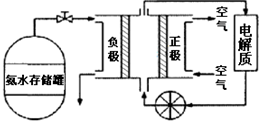
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯气与氢氧化钠溶液:Cl2+2OH-=Cl-+ClO-+H2O | |
| B. | 将少量金属钠放人冷水中:Na+2H2O=Na++2OH-+H2↑ | |
| C. | 向亚硫酸钠溶液中加入足量硝酸:SO32-+2H+=SO2↑+H2O | |
| D. | 向澄清石灰水中通入过量二氧化碳:CO2+Ca2++2OH-=CaCO3↓+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:
有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子后3p轨道全满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为40%,且其核内质子数等于中子数.R是由A、D两元素形成的离子化合物,其中A与D离子数之比为2:1.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com