
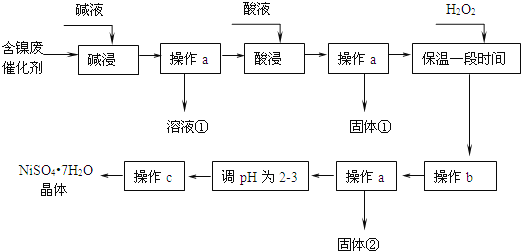
【题目】镍是有机合成的重要催化剂.某化工厂有含镍催化剂废品![]() 主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质
主要成分是镍,杂质是铁、铝单质及其化合物,少量难溶性杂质![]() 某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
某学习小组设计如下流程利用含镍催化剂废品制备硫酸镍晶体:
几种难溶碱开始沉淀和完全沉淀的pH:
沉淀物 | 开始沉淀 | 完全沉淀 |
|
|
|
|
|
|
|
|
|
|
|
|
回答下列问题:
![]() 溶液
溶液![]() 中含金属元素的离子是 ______ .
中含金属元素的离子是 ______ .
![]() 用离子方程式表示加入双氧水的目的 ______
用离子方程式表示加入双氧水的目的 ______ ![]() 双氧水可以用下列物质替代的是 ______ .
双氧水可以用下列物质替代的是 ______ .
A.氧气![]() 漂液
漂液![]() 氯气
氯气![]() 硝酸
硝酸
![]() 操作b调节溶液范围为
操作b调节溶液范围为![]() ,其目的是 ______ .
,其目的是 ______ .
![]() 操作a和c需要共同的玻璃仪器是 ______
操作a和c需要共同的玻璃仪器是 ______ ![]() 上述流程中,防止浓缩结晶过程中
上述流程中,防止浓缩结晶过程中![]() 水解的措施是 ______ .
水解的措施是 ______ .
![]() 如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是 ______
如果加入双氧水量不足或“保温时间较短”,对实验结果的影响是 ______ ![]() 设计实验证明产品中是否含“杂质”
设计实验证明产品中是否含“杂质”![]() 不考虑硫酸镍影响
不考虑硫酸镍影响![]() : ______ .
: ______ .
【答案】![]()
![]() A 除去
A 除去![]() 玻璃棒 调节溶液pH为
玻璃棒 调节溶液pH为![]() 产品中混有绿矾 取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有
产品中混有绿矾 取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有![]()
【解析】
(1)根据废料成分知,碱和铝、氧化铝反应,溶液中含有偏铝酸根离子;
(2)根据数据表知,应将亚铁离子转化成铁离子除去,加入双氧水氧化亚铁离子生成铁离子,不引入新杂质.用漂白液(主要成分次氯酸钠)、氯气、硝酸替代双氧水会引入新杂质.用氧气替代双氧水;
(3)调节溶液pH使Fe3+完全沉淀,使Ni2+不沉淀;
(4)过滤、蒸发都需要用玻璃仪器:玻璃棒,氢氧化镍难溶于水,在结晶过程中,硫酸镍可能水解,保持溶液较强酸性,抑制镍离子水解;
(5)如果加入双氧水不足,或反应时间较短,亚铁离子不能完全转化成铁离子,产品中会混有硫酸亚铁晶体,检验Fe2+试剂可以是氯水,KSCN溶液、酸性高锰酸钾溶液等。
![]() 碱和铝、氧化铝均能反应,溶液中含有的含有金属的离子是偏铝酸根离子;
碱和铝、氧化铝均能反应,溶液中含有的含有金属的离子是偏铝酸根离子;
![]() 亚铁离子具有还原性,双氧水具有氧化性,加入双氧水是为了氧化亚铁离子成为铁离子,离子反应方程式为:
亚铁离子具有还原性,双氧水具有氧化性,加入双氧水是为了氧化亚铁离子成为铁离子,离子反应方程式为:![]() ,漂白液
,漂白液![]() 主要成分次氯酸钠
主要成分次氯酸钠![]() 、氯气、硝酸替代双氧水会引入新杂质,则此替代试剂为氧气,故答案为 A;
、氯气、硝酸替代双氧水会引入新杂质,则此替代试剂为氧气,故答案为 A;
![]() 由表格可知,氢氧化铁的沉淀范围为,
由表格可知,氢氧化铁的沉淀范围为,![]() ,镍离子的沉淀范围是
,镍离子的沉淀范围是![]() ,调节pH在
,调节pH在![]() 的目的是除去铁离子,但是不沉淀镍离子;
的目的是除去铁离子,但是不沉淀镍离子;
![]() 操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到
操作a是过滤得到固体和滤液,c是蒸发浓缩得到晶体过滤得到![]() ,操作a、c中均需使用的仪器为玻璃棒,镍离子水解呈酸性,溶液始终保持溶液呈酸性可以抑制其水解;
,操作a、c中均需使用的仪器为玻璃棒,镍离子水解呈酸性,溶液始终保持溶液呈酸性可以抑制其水解;
![]() 如果加入双氧水不足,或反应时间较短,亚铁离子不能完全被氧化成铁离子,产品中混有绿矾;亚铁离子可以被氧化为铁离子,加入氧化剂即可验证,正确的方法是:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子。
如果加入双氧水不足,或反应时间较短,亚铁离子不能完全被氧化成铁离子,产品中混有绿矾;亚铁离子可以被氧化为铁离子,加入氧化剂即可验证,正确的方法是:取少量样品溶于蒸馏水,滴加酸性高锰酸钾溶液,若溶液紫色褪去,则产品中含有亚铁离子。


 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 都是锂离子电池的电极材料,可利用钛铁矿
都是锂离子电池的电极材料,可利用钛铁矿![]() 主要成分为
主要成分为![]() ,还含有少量MgO、
,还含有少量MgO、![]() 等杂质
等杂质![]() 来制备,工艺流程如下:
来制备,工艺流程如下:
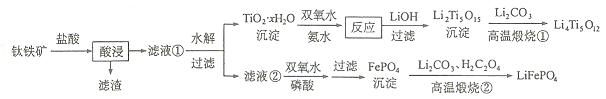
回答下列问题:
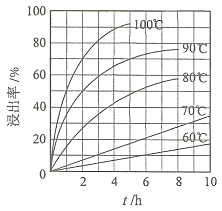
![]() “酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为
“酸浸”实验中,铁的浸出率结果如下图所示。由图可知,当铁的浸出率为![]() 时,所采用的实验条件为______。
时,所采用的实验条件为______。
![]() “酸浸”后,钛主要以
“酸浸”后,钛主要以![]() 形式存在,写出相应反应的离子方程式______。
形式存在,写出相应反应的离子方程式______。
![]() 沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
沉淀与双氧水、氨水反应40min所得实验结果如下表所示:
温度 | 30 | 35 | 40 | 45 | 50 |
| 92 | 95 | 97 | 93 | span>88 |
分析![]() 时
时![]() 转化率最高的原因______。
转化率最高的原因______。
![]() 中Ti的化合价为
中Ti的化合价为![]() ,其中过氧键的数目为______。
,其中过氧键的数目为______。
![]() 若“滤液
若“滤液![]() ”中
”中![]() ,加入双氧水和磷酸
,加入双氧水和磷酸![]() 设溶液体积增加1倍
设溶液体积增加1倍![]() ,使
,使![]() 恰好沉淀完全即溶液中
恰好沉淀完全即溶液中![]() ,此时是否有
,此时是否有![]() 沉淀生成?______
沉淀生成?______![]() 列式计算
列式计算![]() 。
。![]() 、
、![]() 的
的![]() 分别为
分别为![]() 、
、![]()
![]() 写出“高温煅烧
写出“高温煅烧![]() ”中由
”中由![]() 制备
制备![]() 的化学方程式______。
的化学方程式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室制备 1,2二溴乙烷的反应原理如下:
CH3CH2OH![]() CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
CH2=CH2+H2O CH2=CH2+Br2―→BrCH2CH2Br
可能存在的主要副反应有:乙醇在浓硫酸的存在下在140℃脱水生成乙醚。用少量溴和足量的乙醇 制备1,2-二溴乙烷的装置如下图所示:
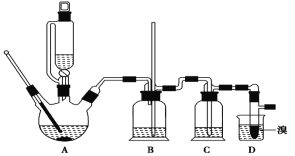
有关数据列表如下:
乙醇 | 1 ,2-二溴乙烷 | 乙醚 | |
状态 | 无色液体 | 无色液体 | 无色液体 |
密度/g·cm-3 | 0 .79 | 2.2 | 0 .71 |
沸点/℃ | 78.5 | 132 | 34.6 |
熔点/℃ | -130 | 9 | -116 |
回答下列问题:
(1)在此制备实验中,要尽可能迅速地把反应温度提高到170℃左右,其最主要目的是_________。(填正确选项前的字母)
a.引发反应 b.加快反应速度
c.防止乙醇挥发 d.减少副产物乙醚生成
(2)在装置 C 中应加入________,其目的是吸收反应中可能生成的酸性气体。(填正确选项前的字母)
a.水 b.浓硫酸 c.氢氧化钠溶液 d.饱和碳酸氢钠溶液
(3)判断 1,2-二溴乙烷制备反应已经结束的最简单方法是_________________________。
(4)将 1,2 二溴乙烷粗产品置于分液漏斗中加水,振荡后静置,产物应在__________________层(填“上”、“下”)。
(5)若产物中有少量未反应的 Br2,最好用___________洗涤除去。(填正确选项前的字母)
a.水 b.氢氧化钠溶液 c.碘化钠溶液 d.乙醇
(6)若产物中有少量副产物乙醚,可用_____的方法除去。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将1molCO和1molNO2充入密闭容器中,在催化剂存在下发生反应NO2(g)+CO(g)![]() CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
CO2(g)+NO(g)并达到化学平衡,发现有50%的CO转化为CO2。在其它条件不变的情况下,若将1molCO和2molNO2充入上述反应器中,则反应达到化学平衡时,混合气体中CO2的体积分数是( )
A.1/9B.1/6C.2/9D.1/3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知海水中的溴含量约为65 mg/L,从海水中提取溴的工业流程如下:
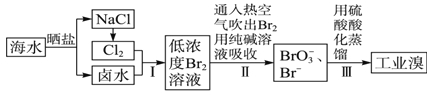
(1)上述步骤Ⅰ中已获得游离态的溴,步骤Ⅱ又将其转化成化合态的溴,目的是_____________。
(2)步骤Ⅱ通入热空气吹出Br2,利用了溴的____________(填序号)。
A.氧化性 B.还原性 C.挥发性 D.腐蚀性
(3)步骤Ⅱ中涉及的离子反应如下,请在方框内填入正确的化学计量数:
_____Br2+_____CO32-=_____BrO3-+_____Br-+_____ CO2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电石浆是氯碱工业中的一种废弃物,其大致组成如表所示:
成分 | CaO | SiO2 | Al2O3 | Fe2O3 | MgO | CaS | 其它不溶性的物质 |
质量分数/% | 65~66 | 3.5~5.0 | 1.5~3.5 | 0.2~0.8 | 0.2~1.1 | 1.0~1.8 | 23~26 |
用电石浆可生产无水CaCl2,某化工厂设计了以下工艺流程:
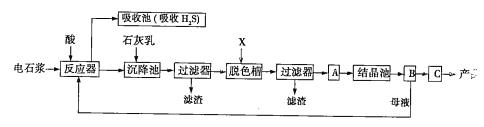
已知氯化钙晶体的化学式是CaCl2·6H2O;H2S是一种酸性气体,且具有还原性。
(1)反应器中加入的酸应选用______________。
(2)脱色槽中应加入的物质X是__________;设备A的作用是__________;设备B的名称为__________;设备C的作用是_______________。
(3)为了满足环保要求,需将废气H2S通入吸收池,下列物质中最适合作为吸收剂的是_______(填序号)。反应的化学方程式为____________________________。
A.水 B.浓硫酸 C.石灰乳 D.硝酸
(4)将设备B中产生的母液重新引入反应器的目的是______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸锶(SrSO4)在水中的沉淀溶解平衡曲线如下图,
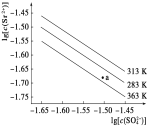
下列说法正确的是( )
A. 313K时,根据曲线计算可知Ksp(SrSO4) 数量级为10-5
B. 三个不同温度中,313 K时Ksp(SrSO4)最大
C. 283 K时,图中a点对应的溶液是饱和溶液
D. 283 K下的SrSO4饱和溶液升温到363 K后变为不饱和溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】福酚美克是一种影响机体免疫功能的药物,可通过以下方法合成:
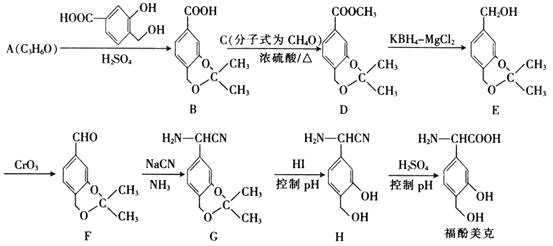
已知:
①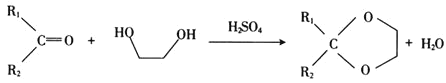 ;
;
②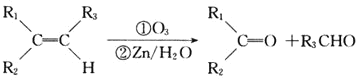 。
。
(1)C的名称为________,A的结构简式为________________。
(2)福酚美克中所含官能团有________________![]() 填名称
填名称![]() 。
。![]() 的反应类型为________。
的反应类型为________。
(3)已知![]() 的转化属于取代反应,则该反应的另一产物的结构简式为________。
的转化属于取代反应,则该反应的另一产物的结构简式为________。
(4)写出F发生银镜反应的化学方程式:________________________________。
(5)E的一种同分异构体Q满足下列条件,则Q的结构简式为________。
①Q的苯环上只有2个取代基,且Q的核磁共振氢谱图中有4组吸收峰
②Q能与![]() 溶液发生显色反应
溶液发生显色反应
③![]() 最多能与
最多能与![]() 发生反应
发生反应
(6)根据已有知识并结合题给信息,写出以![]() 为原料
为原料![]() 无机试剂任用
无机试剂任用![]() 制备
制备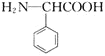 的合成路线流程图_________
的合成路线流程图_________![]() 无机试剂任选
无机试剂任选![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com