
| A. | 0.1mol/L NH4Cl溶液与0.05mol/L NaOH溶液等体积混合后所得的碱性溶液中:c(Cl-)>c(Na+)>c(NH${\;}_{4}^{+}$)>c(OH-)>c(H+) | |
| B. | pH=2的HA溶液与pH=12的MOH溶液等体积混合:c(M+)=c(A-)>c(OH-)=c(H+) | |
| C. | 等物质的量的NaClO、NaHCO5混合溶液中:c(HClO)+c(ClO-)═c(HCO3-)+c(H2CO3)+c(CO32-) | |
| D. | 某二元弱酸的酸式盐NaHA溶液:c(Na+)+c(H+)=c(OH-)+c(HA-)+c(A2-) |
分析 A.反应后溶质为等浓度的氯化铵、一水合氨和氯化钠,氯离子浓度最大,由于一水合氨的电离程度大于铵根离子的水解,则c(NH4+ )>c(Na+);
B.没有告诉HA、MOH是强电解质还是弱电解质,无法判断溶液的酸碱性,则无法判断各离子浓度大小;
C.根据混合液中的物料守恒判断;
D.根据该溶液中的电荷守恒判断.
解答 解:A.0.1mol/L NH4Cl溶液与0.05mol/L NaOH溶液等体积混合后所得的碱性溶液中,溶质为等浓度的氯化铵、一水合氨和NaCl,氯离子浓度最大,由于一水合氨的电离程度大于铵根离子的水解,则c(NH4+ )>c(Na+),溶液中离子浓度大小为:c(Cl-)>c(NH4+ )>c(Na+)>c(OH-)>c(H+),故A错误;
B.pH=2的HA溶液与pH=12的MOH溶液等体积混合,由于不知道HA、MOH是强电解质还是弱电解质,无法判断溶液的酸碱性,则无法判断c(M+)与c(A-)、c(OH-)与c(H+)的大小,故B错误;
C.等物质的量的NaClO、NaHCO3混合溶液中,根据物料守恒可得:c(HClO)+c(ClO-)=$\frac{1}{2}$c(Na+)=c(HCO3-)+c(H2CO3)+c(CO32-),故C正确;
D.根据二元弱酸的酸式盐NaHA溶液中的电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(HA-)+2c(A2-),故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,A为易错点,注意一水合氨的电离程度大于铵根离子的水解,则c(NH4+ )>c(Na+).


科目:高中化学 来源: 题型:选择题
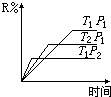 在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )
在密闭容器中进行下列反应:M(气)+N(气)?R(气)+2S(?),此反应符合下面图象,下列叙述是正确的是( )| A. | 正反应吸热,S是气体 | B. | 正反应吸热,S是固体 | ||
| C. | 正反应放热,S是气体 | D. | 正反应放热,S是固体或液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu2+ Na+ NO3- S2- | B. | Mg2+ H+ SO42- NO3- | ||
| C. | Al3+ Na+ HCO3- SO42- | D. | Fe3+ H+ SCN- Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 含有大量ClO-的溶液中:K+、Na+、I ?、SO32? | |
| B. | 使pH试纸变深蓝色的溶液中:NH4+、Na+、SO42?、Cl- | |
| C. | 在c(H+)=1.0×10-13mol•L-1的溶液中:Na+、SO42-、AlO2-、K+ | |
| D. | c(Al3+)=0.1 mol•L-1的溶液中:Na+、NH4+、AlO2?、SO42? |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
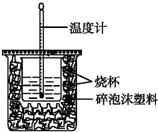 (1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
(1)已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3kJ•mol-1.用50mL0.50mol•L-1盐酸与50mL0.55mol•L-1NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 任何化学反应都伴随有能量的变化 | |
| B. | 化学能与电能的相互转化必须通过一定的装置 | |
| C. | 太阳能、风能、氢能、电能都是可再生的新能源 | |
| D. | 能源的开发和利用情况可以衡量一个国家或地区的经济发展和科学技术水平 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH增大 | B. | c(CH3COOH)增大 | ||
| C. | CH3COOH电离程度增大 | D. | c(H+)×c(OH-)=1×10-14 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤⑥ | C. | ②④⑥⑦ | D. | ①②③④⑤⑥⑦ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com