
【题目】以磷石膏![]() 主要成分CaSO4,杂质SiO2、Al2O3等
主要成分CaSO4,杂质SiO2、Al2O3等![]() 为原料可制备轻质CaCO3。
为原料可制备轻质CaCO3。

“转化”步骤中浆料清液的pH和c(SO42-)随时间变化如图,下列说法正确的是

A.为提高磷石膏粉的转化率,应通入过量的CO2
B.“转化”步骤,应控制溶液的pH约为7
C.高温煅烧时可发生反应![]() ,从而除去SiO2杂质
,从而除去SiO2杂质
D.向浸取液中通入CO2,可沉淀出几乎所有钙元素,后经过滤、洗涤、烘干即可获得轻质CaCO3
【答案】C
【解析】
磷石膏氨水的浆料中通入CO2可生成碳酸盐或碳酸氢盐,过滤后滤液为硫酸铵、氨水,滤渣为CaCO3、SiO2、Al2O3等,高温煅烧可生成CaSiO3、Ca(AlO2)2等,加入氯化铵溶液充分浸取,可生成H2SiO3、Al(OH)3、CaCl2,最终可生成CaCO3,据此进行分析和判断。
A. 为提高磷石膏粉的转化率,可利用搅拌、增大氨水浓度等方法,通入过量的CO2不能提高磷石膏粉的转化率,A项错误;
B. “转化”时,发生的是硫酸钙转化为碳酸钙的反应,当控制pH<8时,CaCO3逐渐溶解,溶液中Ca2+浓度增大,形成了CaSO4的饱和溶液,因此“转化”步骤,不能将溶液的pH控制为7,B项错误;
C. 高温煅烧时,碳酸钙可与SiO2反应生成硅酸钙与CO2,可达到除去SiO2的目的,且方程式为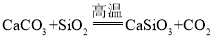 ,C项正确;
,C项正确;
D. 向浸取液中通入CO2,可沉淀Ca2+,但当通入过量的CO2时,CaCO3逐渐溶解,因此通入CO2不能沉淀出所有钙元素,D项错误;
答案选C。


 智趣寒假作业云南科技出版社系列答案
智趣寒假作业云南科技出版社系列答案科目:高中化学 来源: 题型:
【题目】“软电池”采用一张薄层纸片作为传导体,一面镀Zn,另一面镀MnO2。电池总反应为Zn+2MnO2+H2O=2MnO(OH)+ZnO。下列说法正确的是( )
A.该电池的正极为ZnO
B.Zn电极附近溶液的pH不变
C.电池正极的电极反应为2MnO2+2e-+2H2O=2MnO(OH)+2OH-
D.当0.1molZn完全溶解时,流经电解液的电子的物质的量为0.2mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在Na+浓度为1.0mol/L的某澄清溶液中,还可能含有K+,Mg2+,Fe3+,Ba2+,Cl-,CO32-,SO32-,SiO32-,SO42-等离子,取该溶液100ml进行下图连续实验(所加试剂均过量,气体全部逸出)。下列说法不正确的是
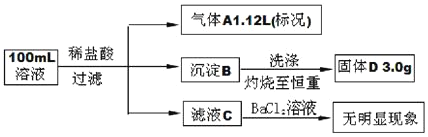
A.原溶液中一定不存在Mg2+,Fe3+,Ba2+,SO42-
B.在100ml原溶液中加入足量BaCl2溶液,至少可生成沉淀20.5g
C.为确定原溶液中是否含有Cl-,可取滤液C,加入AgNO3和稀HNO3溶液
D.原溶液一定存在K+,c(K+)可能为1.5mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.10 mol·L-1CH3COOH
溶液和HCN溶液所得滴定曲线如右图。下列说法正确的是

A. 点①和点②所示溶液中:c(CH3COO-)<c(CN-)
B. 点③和点④所示溶液中:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
C. 点①和点②所示溶液中:c(CH3COO-)-c(CN-)=c(HCN)-c(CH3COOH)
D. 点②和点③所示溶液中都有:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】明矾[KAl(SO4)212H2O]在生产、生活中有广泛用途:饮用水的净化;造纸工业上作施胶剂;食品工业的发酵剂等。利用炼铝厂的废料—铝灰(含 Al、Al2O3 及少量 SiO2 和 FeOxFe2O3)可制备明矾。工艺流程如下:

回答下列问题:
(1)欲配制 480 ml 1.0 mol / L H2SO4 溶液,需要 18 mol / L H2SO4 溶液的体积是 __,已有下列仪器:烧杯,量筒,胶头滴管,玻璃棒,还需用到的仪器是 ______。
(2)明矾净水的原理是 ________(用离子方程式表示)。
(3)检验滤液 A 中是否存在 Fe2+ 的实验操作是 ________。
(4)在滤液 A 中加入高锰酸钾溶液的目的是 ______(用离子方程式表示)(该条件下 MnO4- 转化为 Mn2+)
(5)已知:加入 MnSO4,Mn2+ 可与 MnO4- 反应生成 MnO2,该反应氧化剂与还原剂的物质的量之比为 ____。
(6)操作Ⅱ是 _____、______、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】断肠草(Gelsemium)为中国古代九大毒药之一,据记载能“见血封喉”,现代查明它是葫蔓藤科植物葫蔓藤,其中的毒素很多,下列是分离出来的四种毒素的结构简式,下列推断正确的是( )
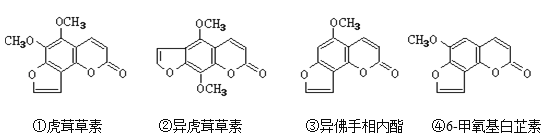
A.②中所含官能团种类比③中多
B.①、④互为同系物
C.①、②、③、④均能与氢氧化钠溶液反应
D.等物质的量②、③分别在足量氧气中完全燃烧,前者消耗氧气比后者少
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】由CH3CH2CH2Br制备CH3CH(OH)CH2OH,依次发生的反应类型和反应条件都正确的是
选项 | 反应类型 | 反应条件 |
A | 加成、取代、消去 | KOH醇溶液/加热、KOH水溶液/加热、常温 |
B | 消去、加成、取代 | NaOH醇溶液/加热、常温、KOH水溶液/加热 |
C | 氧化、取代、消去 | 加热、KOH醇溶液/加热、KOH水溶液/加热 |
D | 消去、加成、水解 | NaOH水溶液/加热、常温、NaOH醇溶液/加热 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:pAg=-lg[c(Ag+)]。Ksp(AgCl)=1×10-10,Ksp(AgI)=1×10-17。如图是向10mlAgNO3溶液中加入0.1molL-1溶液时,溶液的pAg随着加入NaCl溶液的体积变化的图像![]() 实线
实线![]() 。根据图像所得下列结论正确的是( )
。根据图像所得下列结论正确的是( )

A.原AgNO3溶液的物质的量浓度为0.1molL-1
B.图中x点表示溶液中c(Ag+)= c(Cl-)
C.图中x点的坐标为(10,5)
D.把NaCl溶液换成0.1molL-1的NaI溶液,则图像在终点后变为虚线部分
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验:①将![]() 溶液和
溶液和![]() 溶液等体积混合得到浊液;②取少量①中浊液,滴加
溶液等体积混合得到浊液;②取少量①中浊液,滴加![]() 溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加
溶液,出现红褐色沉淀;③将①中浊液过滤取少量白色沉淀,滴加![]() 溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
溶液.沉淀变为红褐色。下列说法中,不正确的是 ( )
A. 将①中浊液过滤,所得滤液中含少量![]()
B. ①中浊液存在平衡:![]()
C. ②中沉淀颜色变化说明![]() 转化为
转化为![]()
D. ③可以证明![]() ,比
,比![]() 更难溶
更难溶
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com