
(1)下列说法正确的是________(选填序号)。
A.在进行物质检验时,一般先对试样进行外观观察,确定其状态、颜色、气味等
B.配制银氨溶液时,应把硝酸银溶液逐滴加入氨水中
C.一般在实验室点燃可燃性气体时,必须先要检验纯度
D.测定硫酸铜晶体结晶水的质量分数时,若用潮湿的坩埚会使测定结果偏小
E.酸碱中和滴定实验中根据碱式滴定管的两次读数得出NaOH溶液体积为22.0 mL
F.实验室制取氯气等有毒气体时,必须在密闭体系或通风橱中进行
(2)补铁剂中铁元素的含量是质检部门衡量其质量的重要指标,实验主要包括如下步骤:
a.配制0.01 mol/L到0.008 mol/L等一系列浓度的[Fe(SCN)6]3-(红色)溶液作为标准比色液。
b.样品处理:
c.准确量取一定体积的待测液于比色管中,加入稍过量的KSCN溶液,并稀释到10 mL。
d.比色:选取与待测液颜色一致或相近的标准比色液即可判断待测液的浓度。
试回答下列问题:
①配制100 mL 0.01mol/L标准溶液,需要的玻璃仪器有:烧杯、玻璃棒、量筒,还需要:________、________。
②步骤b脱色过程包括加入:________(填:脱有机色素的吸附剂名称)→搅拌→煮沸→冷却→________(填操作)。
③步骤b样品处理中,氧化的目的是________。
科目:高中化学 来源: 题型:
下列各组离子能在pH=1的无色溶液中大量共存的是( )
|
| A. | Ba2+、Na+、I﹣、ClO﹣ | B. | Mg2+、Cl﹣、Al3+、SO42﹣ |
|
| C. | K+、Cl﹣、HCO3﹣、NO3﹣ | D. | Ca2+、Na+、Fe3+、AlO2﹣ |
查看答案和解析>>
科目:高中化学 来源: 题型:
将40 g NaOH溶于水中,配制成1 L溶液,则该溶液的物质的量浓度为( )。
A.0.1 mol/L B.0.5 mol/L C.4 mol/L D.1 mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
在3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O反应中,氧化剂_______,被氧化的元素是 _______,还原产物是 ,该反应中转移电子的物质的量是 mol,用单线桥法表示该反应 _______。
查看答案和解析>>
科目:高中化学 来源: 题型:
关于有机物结构、性质、鉴别的叙述正确的是
A.淀粉和纤维素都是多糖,其分子式为 (C6H10O5) n
B.乙烯和苯都能使溴水褪色,故不能用溴水鉴别乙烯和苯蒸气
C.NH4Cl可以使蛋白质变性形成沉淀从溶液中析出
D.苯与酸性KMnO4溶液混合振荡、静置分层,下层液体为无色
查看答案和解析>>
科目:高中化学 来源: 题型:
下列各项中所列举的物质与所属类别对应不正确的是( )
A.非电解质:乙醇 四氯化碳 氯气 SO3
B.混合物:铝热剂 纯净矿泉水 碱石灰 漂白粉
C.同素异形体:活性炭 C60 石墨烯 金刚石
D.化合物:干冰 冰水混合物 烧碱 小苏打
查看答案和解析>>
科目:高中化学 来源: 题型:
A为药用有机物,从A出发可发生下图所示的一系列反应。已知A在一定条件下能跟醇发生酯化反应,A分子中苯环上的两个取代基连在相邻的碳原子上;D不能跟NaHCO3溶液反应,但能跟NaOH溶液反应。
|
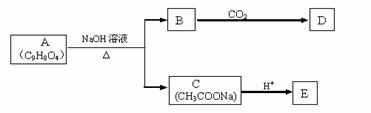
(1)A中所含官能团的名称为______________;A转化为B、C时,涉及到的反应类型有_____________________________。
(2)E的两种同分异构体Q、R都能在一定条件下发生银镜反应,R能与Na反应放出H2,而Q不能。则Q、R的结构简式为Q__________________、R______________________。
(3)写出B与过量CO2反应的化学方程式__________________。
(4)A在加热条件下与NaOH溶液反应的化学方程式为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
离子方程式H++OH-=H2O可表示的化学方程式是
A.盐酸与氢氧化铜的反应 B.硫酸与氢氧化钡的反应
C.硫酸与氢氧化钠的反应 D.盐酸与氨水的反应
查看答案和解析>>
科目:高中化学 来源: 题型:
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力。

(1)太阳能热水器中常使用一种以镍或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的外围电子排布式__________,它位于周期表____________区。
(2) 富勒烯衍生物由于具有良好的光电性能,在太阳能电池的应用上具有非常光明的前途。富勒烯(C60)的结构如右图,分子中碳原子轨道的杂化类型为________;1 mol C60分子中σ键的数目为____________个。
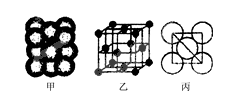
(3)Cu单质晶体中原子的堆积方式如右图甲所示,其晶胞特征如右图乙所示,原子之间相互位置关系的平面图如右图丙所示。晶胞中Cu原子的配位数为____________,一个晶胞中Cu原子的数目为________。
(4)Fe(CO)5常温下呈液态,熔点为-20.5 ℃,沸点为103 ℃,易溶于非极性溶剂,据此可判断Fe(CO)5晶体属于________(填晶体类型);Fe(CO)5是配合物,配体.配位数分别是________.________。
(5)下列说法正确的是________。
A.第一电离能大小:S>P>Si
B.电负性顺序:C<N<O<F
C.因为晶格能CaO比KCl高,所以KCl比CaO熔点低
D.SO2与CO2的化学性质类似,分子结构也都呈直线型,相同条件下SO2的溶解度更大
E.分子晶体中,共价键键能越大,该分子晶体的熔.沸点越高
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com