
分析 (1)令NO和NO2的物质的量分别为xmol、ymol,根据二者体积及电子转移守恒列方程计算,再根据V=nVm计算各自体积;(1)n(Cu)=$\frac{32.64g}{64g/mol}$=0.51mol,氮氧化物的物质的量=$\frac{11.2L}{22.4L/mol}$=0.5mol,根据得失电子守恒计算二者的物质的量,再根据M=$\frac{m}{n}$计算其平均摩尔质量;
(2)根据N原子守恒计算作氧化剂的硝酸的物质的量,根据硝酸钠的化学式计算起酸作用的硝酸,再根据物质的量浓度公式计算硝酸的物质的量浓度;
(3)欲使铜与硝酸反应生成的气体在NaOH溶液中全部转化为NaNO3,结合(1)根据得失电子守恒分析,或者硝酸钠中的氮是+5价,所以铜失电子全部给铜来求解.
解答 解:(1)32.64g铜的物质的量为$\frac{32.64g}{64g/mol}$=0.51mol,在反应中失去的电子的物质的量为2×0.51mol=1.02mol,11.2L混合气体的物质的量为$\frac{11.2L}{22.4L/mol}$=0.5mol,令NO和NO2的物质的量分别为xmol、ymol,则:
x+y=0.5
3x+y=1.02,
解得x=0.26、y=0.24,
NO的物质的量=0.26mol,
NO2的物质的量=0.24mol,
故答案为:0.26;0.24;
(2)将铜离子完全转化为硝酸钠时,根据钠原子守恒得n(NaOH)=n(NaNO3)=0.001aVmol,根据硝酸根离子守恒得起酸作用的硝酸的物质的量=0.001aVmol,根据N原子守恒作氧化剂的硝酸的物质的量=0.5mol,所以硝酸的物质的量浓度=$\frac{0.5mol+0.001aVmol}{0.14L}$=$\frac{50+0.1aV}{14}$mol/L,
故答案为:$\frac{50+0.1aV}{14}$;
(3)设需要30%的双氧水mg,根据电子得失守恒,有:0.26×3+0.24×1=0.51×2=30%×$\frac{m}{34}$×2,解得:m=57.8g,
故答案为:57.8.
点评 本题以硝酸为载体考查了氧化还原反应的计算,根据氧化还原反应中得失电子进行解答即可,注意守恒思想的运用,注意(2)中不能根据铜计算消耗硝酸的物质的量,铜和硝酸反应时,硝酸可能有剩余,为易错点,题目难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 把相同大小的Al和Mg分别投入相同浓度的NaOH溶液中:Al溶解有气泡放出,而Mg没有任何变化.由此得出:Al的金属性比镁强 | |
| B. | 取一块铝箔,用酒精灯点燃:铝箔只熔化成液体而没有脱落.由此得出:铝不能燃烧 | |
| C. | 向氯化铵溶液中投入一铝片:铝片上产生大量气泡.由此得出:该气体一定是氨气 | |
| D. | 向AlCl3溶液中逐滴滴加NaOH溶液至过量:先产生白色沉淀,后沉淀逐渐溶解,最后沉淀完全消失.由此得出:Al(OH)3能溶于强碱溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 饱和溶液 | 加入的少量物质 | |
| A | NaHCO3 | 石灰水 |
| B | 盐酸 | 氢氧化钠溶液 |
| C | Na2CO3 | CO2 |
| D | Ca(OH)2 | CaCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
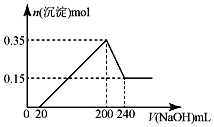 将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )
将一定质量的镁和铝的混合物投入100mL盐酸中,固体全部溶解后,向所得溶液中加入NaOH溶液,生成沉淀的物质的量与加入NaOH溶液的体积关系如图所示.若不考虑金属和盐酸反应时HCl的挥发.则下列说法正确的是( )| A. | NaOH溶液的物质的量浓度为2.5mol•L-1 | |
| B. | 盐酸的物质的量浓度为5mol•L-1 | |
| C. | 镁和铝的总质量为9g | |
| D. | 生成的氢气在标准状况下的体积为11.2L |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铂丝蘸取少量A溶液于酒精灯上灼烧,透过钴玻璃,可观察到蓝色火焰 | |
| B. | A溶液中存在c(K+)+c(NH4+)+3 c(Fe3+)=2 c(SO42-)+c(Cl-) | |
| C. | y+z=16 | |
| D. | 若④中沉淀灼烧不充分,将导致z偏小 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
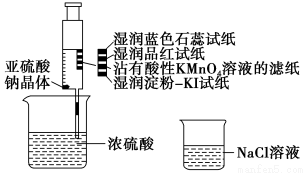
| A. | 蓝色石蕊试纸先变红后褪色 | |
| B. | 品红试纸、蘸有酸性KMnO4溶液的滤纸均褪色,证明SO2具有漂白性 | |
| C. | 湿润淀粉-KI试纸未变蓝说明SO2的氧化性弱于I2 | |
| D. | NaCl溶液可用于除去实验中多余的SO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com