
随着卤素原子半径的增大,下列递变规律正确的是
| A.单质的熔点逐渐降低 | B.卤素离子还原性逐渐增强 |
| C.气态氢化物稳定性逐渐增强 | D.单质氧化性逐渐增强 |
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。
请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号)____________________。
(2)X与Y能形成多种化合物,其中既含极性键又含非极性键,且相对分子质量最小的物质是(写分子式)________________。
(3)由以上某些元素组成的化合物A、B、C、D有如下转化关系:A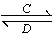 B(在水溶液中进行)
B(在水溶液中进行)
其中,C是溶于水显酸性的气体;D是淡黄色固体。
写出C的结构式:________;D的电子式:________。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为________________________;由A转化为B的离子方程式为___________________。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因:
________________________________________________________________________。
A、B浓度均为0.1 mol·L-1的混合溶液中,离子浓度由大到小的顺序是____________________;常温下,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
X、Y、Z、Q、R是五种短周期元素,原子序数依次增大。X、Y两元素最高正价与最低负价之和均为0;Q与X同主族;Z、R分别是地壳中含量最高的非金属元素和金属元素。请回答下列问题:
(1)五种元素原子半径由大到小的顺序是(写元素符号) 。
(2)由以上某些元素组成的化合物A、B、C、D有如下转化关系: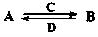 (在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
(在水溶液中进行)其中,C是溶于水显酸性的气体;D是淡黄色固体。写出C的结构式: ;D的电子式: 。
①如果A、B均由三种元素组成,B为两性不溶物,则A的化学式为 ;由A转化为B的离子方程式为 。
②如果A由三种元素组成,B由四种元素组成,A、B溶液均显碱性。用离子方程式表示A溶液显碱性的原因: 。常温下,A、B浓度均为0.1mol·L-1的混合溶液中,在该溶液中滴加稀盐酸至中性时,溶质的主要成分有 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
一种含铝、锂、钴的新型电子材料,生产中产生的废料数量可观,废料中的铝以金属铝箔的形式存在;钴以Co2O3·CoO的形式存在,吸附在铝箔的单面或双面;锂混杂于其中。
从废料中回收氧化钴(CoO)的工艺流程如下: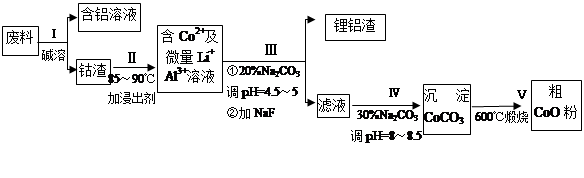
(1)过程I中采用NaOH溶液溶出废料中的Al,反应的离子方程式为 。
(2)过程II中加入稀H2SO4酸化后,再加入Na2S2O3溶液浸出钴。则浸出钴的化学反应方程式为(产物中只有一种酸根) 。在实验室模拟工业生产时,也可用盐酸浸出钴,但实际工业生产中不用盐酸,请从反应原理分析不用盐酸浸出钴的主要原因_______________。
(3)过程Ⅲ得到锂铝渣的主要成分是LiF和Al(OH)3,碳酸钠溶液在产生Al(OH)3时起重要作用,请写出该反应的离子方程式____________________。
(4)碳酸钠溶液在过程III和IV中所起作用有所不同,请写出在过程IV中起的作用是__________。
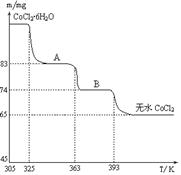
(5)在Na2CO3溶液中存在多种粒子,下列各粒子浓度关系正确的是______(填序号)。
| A.c(Na+) = 2c(CO32-) |
| B.c(Na+) > c(CO32-) > c(HCO3-) |
| C.c(OH-) > c(HCO3-) > c(H+) |
| D.c(OH-) - c(H+) = c(HCO3-) + 2c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
某化学兴趣小组的同学利用下图所示实验装置进行某些气体的制备、性质等实验(图中夹持装置有省略)。请按要求填空: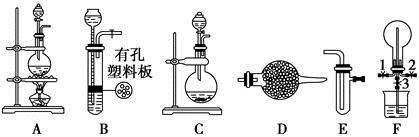
Ⅰ.探究氯气与氨气的反应
(1)为制取干燥氨气,可将装置C与________(填装置编号)连接;装置C中的烧瓶内固体宜选用________。
a.碱石灰 b.氯化钙
c.五氧化二磷 d.生石灰
(2)装置A、E、E连接可制取纯净、干燥的氯气,则两个E装置内的药品依次是________________。
(3)装置F可用于探究氯气与氨气(已知氯气与氨气可发生反应:3Cl2+2NH3=N2+6HCl)的反应。实验时打开弹簧夹1、3,关闭2,先向烧瓶中通入________,然后关闭1、3,打开2,向烧瓶中缓慢通入一定量的另一种气体。实验一段时间后烧瓶内出现浓厚的白烟并在容器内壁凝结,请设计一个实验方案鉴定该固体中的阳离子_____________________________________。
Ⅱ.探究某些物质的性质
(4)利用装置A、E,可设计实验比较Cl-和Br-的还原性强弱,能证明结论的实验现象是_______________________________________________________。
(5)若利用装置A、E进行乙烯与溴水反应的实验,写出反应的化学方程式_________________________________________
(6)将装置B、C分别与F相连后,进行H2S与SO2反应的实验。F的烧瓶中发生反应的化学方程式为______________________;F的烧杯所起的作用是_________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
下列说法正确的是( )
| A.酸雨样品露天放置一段时间,酸性增强,是由于雨水所含成分被氧化的原因 |
| B.CH4、NH3、PH3的热稳定性逐渐增强 |
| C.因为酸性:HC1>HF,所以非金属性:Cl>F |
| D.钠原子在反应中失去的电子比铝原子少,故钠的金属性比铝弱 |
查看答案和解析>>
科目:高中化学 来源: 题型:单选题
已知1—18号元素的离子aW3+、bX+、cY2—、dZ—都具有相同的电子层结构,则下列叙述或表示方法正确的是( )
| A.四种元素位于同一周期 | B.氢化物的稳定性H2Y>HZ |
| C.离子的氧化性aW3+ > bX+ | D.a+3=c﹣2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com