
| A. | 标准状况下,2.24L氯仿(CHCl3)含0.4NA个共价键 | |
| B. | 1molNaHSO4固体含3NA个离子 | |
| C. | NA个H2分子与NA个I2(g)分子反应生成HI(g),反应后容器中含2NA个分子 | |
| D. | 反应:K35ClO3+6H37Cl═3Cl2↑+KCl+3H2O,当有71gCl2生成时,转移0.5NA个电子 |
分析 A.标况下,氯仿为液体;
B.硫酸氢钠是由钠离子与硫酸氢根离子构成;
C.氢气与碘反应生成碘化氢,反应前后分子数不变;
D.生成氯气的相对分子质量=$\frac{35×1+37×5}{3}$=73.3.
解答 解:A.标况下,氯仿为液体,不能使用气体摩尔体积,故A错误;
B.1molNaHSO4固体含1mol钠离子,和1mol硫酸氢根离子,共用2NA个离子,故B错误;
C.氢气与碘反应生成碘化氢,反应前后分子数不变,所以NA个H2分子与NA个I2(g)分子反应生成HI(g),反应后容器中含2NA个分子,故C正确;
D.反应:K35ClO3+6H37Cl═3Cl2↑+KCl+3H2O,当有73.3gCl2生成时,转移0.5NA个电子,则生成71gCl2生成时,转移电子数少于0.5NA,故D错误;
故选:C.
点评 本题考查了阿伏伽德罗常数的应用,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系是解题关键,注意硫酸氢钠的结构,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | 18gD2O和18gH2O中含有的质子数均为10NA | |
| B. | 0.1mol•L-1NaCl溶液中Na+的数目为0.1NA | |
| C. | 11.2 LCO2所含分子数为0.5 NA | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14g,其原子数为3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
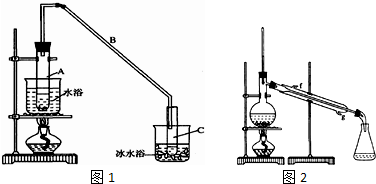
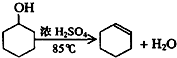
| 密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
| 环己醇 | 0.96 | 25 | 161 | 能溶于水 |
| 环己烯 | 0.81 | -103 | 83 | 难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
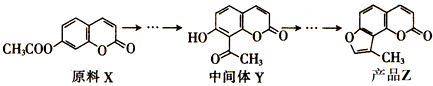
| A. | X与Y互为同分异构体 | |
| B. | X与Y均不能使酸性KMnO4溶液褪色 | |
| C. | 在光照条件下,Z中的苯环能与Cl2发生取代反应 | |
| D. | Z中所有不饱和键均能与溴发生加成反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
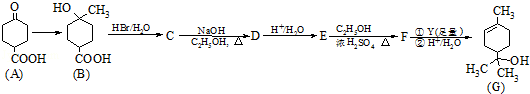
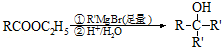
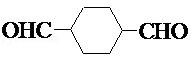 .
.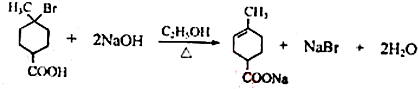 .
.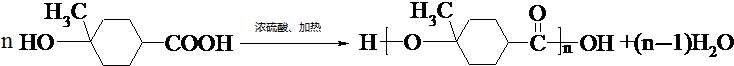 .
.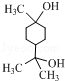 .
.查看答案和解析>>
科目:高中化学 来源: 题型:实验题
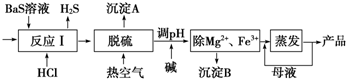
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
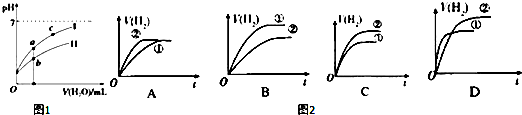
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com