
【题目】设NA表示阿伏加德罗常数,下列说法正确的是
A.5.85g氯化钠所含的离子数为0.1NA
B.2.8gN2中含有共用电子对的数目为0.1NA
C.0.1molF2中含有共价键的数目为0.2NA
D.0.1molH2与Cl2的混合气体充分反应后体系中含有共价键数目为0.1NA
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
【题目】工业以草酸盐共沉淀法获得草酸氧钛钡晶体[BaTiO(C2O4)2·4H2O],煅烧可获得钛酸钡粉体。

(1)“酸浸”应选择_________(填标号);为提高酸浸率,可采取的措施_________(至少答两点)
a. 硫酸 b. 盐酸 c. 硝酸
(2)实验室要完成操作1需要的玻璃仪器有_________。
(3)加入H2C2O4溶液时,发生的反应为______+______TiCl4+_____H2C2O4+ _____H2O= BaTiO(C2O4)2·4H2O↓ + _________;可循环使用的物质X是(写名称)_________。
(4)请简述检验草酸氧钛钡晶体是否洗涤干净的方法_________。
(5)高温煅烧草酸氧钛钡晶体得到BaTiO3的同时,生成的气体产物有CO、和_________。
(6)测定钛酸钡粉体中BaTiO3的质量分数。
已知:Ba2++CrO42-=BaCrO4↓ 2CrO42-+2H+=Cr2O72-+H2O
现取a g煅烧后的BaTiO3粉末酸溶得到100.0 mL含Ba2+的溶液,取25.00 mL于锥形瓶,加入x mL 浓度为C1 mol/L的Na2CrO4溶液(Na2CrO4过量)充分反应后,用浓度为C2 mol/L标准盐酸滴定至CrO42-被完全反应,消耗盐酸体积为y mL。(钛元素不干扰测定过程)已知BaTiO3的摩尔质量为M g/mol,试写出粉体中BaTiO3质量分数的表达式。_________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述中正确的是( )
A. 标准状况下,22.4LCCl4含有的分子数约为6.02×1023个
B. 1L氢气一定比1L氧气质量少
C. 含有6.02×1023个Fe3+的Fe2(SO4)3中SO42﹣的物质的量为3mol
D. 1molAl3+带有的正电荷数为1.806×1024个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验试剂保存正确的是( )
A.将氢氟酸保存在玻璃细口瓶中B.将金属钠保存在冷水中
C.保存 NaOH 的试剂瓶使用橡胶塞D.将金属锂保存在煤油中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨对化学工业和国防工业具有重要意义。
(1)向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)的关系图。

①图A中氨气的体积分数为15%时,H2的转化率为_______。
②图B中T=500℃,则温度为450℃时对应的曲线是_______(填“a”或“b”)。
(2)合成氨所需的氢气可由甲烷与水反应制得,反应的热化学方程式为:CH4(g)+H2O(g)![]() CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
CO(g)+3H2(g) △H>0,一定温度下,在体积为2 L的恒容容器中发生上述反应,各物质的物质的量变化如下表:
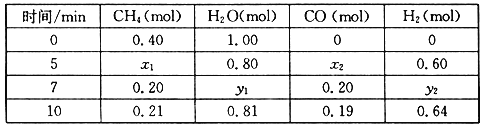
①分析表中数据,判断5 min时反应是否处于平衡状态?_____(填“是”或“否”)。
②该温度下,上述反应的平衡常数K=_____________________。
③反应在7~10 min内,CO的物质的量减少的原因可能是____________(填字母)。
a.减少CH4的物质的量 b.降低温度 c.升高温度 d.充入H2
④下列方法中可以证明上述反应已达平衡状态的是___________。
a.单位时间内生成3n mol H2的同时生成n mol CO
b.容器内压强不再变化
c.混合气体密度不再变化
d.混合气体的平均相对分子质量不再变化
e.CH4的质量分数不再变化
⑤已知碳的气化反应在不同温度下平衡常数的对数值(lgK)如下表:
气化反应式 | lgK | ||
700K | 900K | 1200K | |
C(s)+H2O(g)=CO(g)+H2(g) | -2.64 | -0.39 | 1.58 |
C(s)+2H2O(g)=CO2(g)+2H2(g) | -1.67 | -0.03 | 1.44 |
则反应CO(g)+H2O(g)![]() CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
CO2(g)+H2(g)在900K时,该反应平衡常数的对数值(lgK)=_______。
(3)在容积可变的密闭容器中发生反应:mA(g)+nB(g)![]() pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
pC(g),在一定温度和不同压强下达到平衡时,分别得到A的物质的量浓度如下表:
压强p/Pa | 2×105 | 5×105 | 1×106 |
c(A)/molL-1 | 0.08 | 0.20 | 0.44 |
①当压强从2×105Pa增加到5×105Pa时,平衡______移动(填“正向、逆向或不”)。
②当压强为1×106Pa时,此反应的平衡常数表达式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ. (1)下列条件的改变能增大活化分子百分数的是_____________。
A.增大压强 B.增大反应物的浓度
C.升高温度 D.使用催化剂
(2)破坏(或形成)1 mol化学键所吸收(或放出)的能量称为键能。已知白磷和PCl3的分子结构如图所示,现提供以下化学键的键能(kJ·mol-1):P-P 198、Cl-Cl 243、P-Cl 331。

则反应P4(s,白磷)+6Cl2(g)=4PCl3(s)的反应热△H=__________kJ·mol-1。
Ⅱ.2SO2(g)+O2(g)![]() 2SO3(g)反应过程的能量变化如图所示。
2SO3(g)反应过程的能量变化如图所示。

已知1mol SO2(g)氧化为1mol SO3(g)的△H=-99 kJ·mol-1。请回答下列问题:
(1)图中C表示___________,E表示______________;该反应通常用V2O5作催化剂,加V2O5会使图中B点降低,理由是____________ ;
(2)图中△H=_________kJ·mol-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知磷可以在氯气中燃烧,产物为PCl3和PCl5
①2P+3Cl2=2 PCl3 ②2P+5Cl2=2 PCl5
(1)若有1mol磷按①式完全反应,得到产物________克,在这些产物中含有共价键的数目为________。
(2)若有12.4g磷与0.90mol氯气同时发生①、②两式反应,反应后磷与氯气均无剩余。计算产物中PCl3和PCl5的物质的量。_______________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com