
| A. | 混合物中Fe的物质的量为0.03mol | |
| B. | 混合物中Fe3O4的物质的量为0.01mol | |
| C. | 反应中产生的气体在标准状况下的体积为448mL | |
| D. | 若用足量的CO在高温下与相同质量的上述固体混合物反应,最终能得到7.2g铁 |
分析 向Fe3O4和 Fe的固体混合物6.88g中 加入50ml 2 mol•L-1H2SO4,恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeSO4,发生反应:Fe+2H+=Fe2++H2↑、Fe3O4+8H+=Fe2++2Fe3++4H2O、Fe+2Fe3+=3Fe2+,设原混合物中Fe和Fe3O4的物质的量分别为xmol、ymol,根据混合物的质量和消耗的硫酸的物质的量,结合Fe元素守恒,联立方程计算,根据计算结构对各选项进行判断.
解答 解:设原混合物中Fe和Fe3O4的物质的量分别为xmol、ymol
混合物与H2SO4恰好完全反应,所得溶液中加入KSCN溶液,无血红色出现,说明溶液中的溶质为FeSO4,
则n(Fe2+)=n(H2SO4)=0.05L×2 mol•L-1=0.1mol,
由Fe元素守恒得:x+3y=0.1mol、56x+232y=6.88g,
解得:x=0.04mol、y=0.02mol,
即:混合物中Fe3O4和 Fe的物质的量分别为0.02mol、0.04mol;
A.混合物中Fe的物质的量为0.04mol,故A错误;
B.混合物中Fe3O4的物质的量为0.02mol,故B错误;
C.Fe3O4+8H+=Fe2++2Fe3++4H2O、
0.02 0.04mol
Fe+2Fe3+=3Fe2+,
0.02mol 0.04mol,
生成氢气消耗铁的物质的量为:0.04mol-0.02mol=0.02mol,根据反应Fe+2H+=Fe2++H2↑可知生成氢气的物质的量为0.02mol,标况下氢气体积为:V(H2)=0.02mol×22.4L/mol=0.448L=448mL,故C正确;
D.根据铁元素守恒,原混合物中总共含有0.1mol铁元素,则用足量的CO在高温下与相同质量的上述固体混合物反应,最终能得到0.1mol铁,质量为:56g/mol×0.1mol=5.6g,故D错误;
故选C.
点评 本题考查混合物反应的计算,题目难度中等,利用元素守恒判断铁的物质的量是解题关键,注意守恒思想的运用和三价铁离子的检验方法.


科目:高中化学 来源: 题型:选择题
| A. | NF3的摩尔质量为71g | |
| B. | 还原剂和氧化剂的物质的量之比是2:1 | |
| C. | 若生成0.2mol HNO3,则转移0.2mol电子 | |
| D. | NF3在潮湿的空气中泄漏可观察到红棕色气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 山梨酸易溶于四氯化碳 | |
| B. | 山梨酸能与氢气发生加成反应 | |
| C. | 山梨酸能和乙醇反应生成酯 | |
| D. | 1mol山梨酸能和金属钠反应生成1mol氢气 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
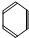 、C:CH3COOH
、C:CH3COOH查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子最外层的电子数随核电荷数的增加而增多 | |
| B. | 单质的氧化性随核电荷数的增加而增强 | |
| C. | 氢化物的稳定性随核电荷数的增加而减弱 | |
| D. | 非金属性随核电荷数的增加而增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 青苹果汁只含淀粉 | B. | 熟苹果汁中只含有葡萄糖 | ||
| C. | 苹果转熟时葡萄糖聚合为淀粉 | D. | 苹果转熟时淀粉水解为葡萄糖 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铝热反应属于吸热反应 | |
| B. | 对于某一反应,若反应物的总能量大于生成物的总能量,则该反应为吸热反应 | |
| C. | 化学反应中既有物质变化又有能量变化 | |
| D. | 凡经加热而发生的化学反应都是吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
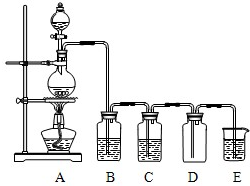
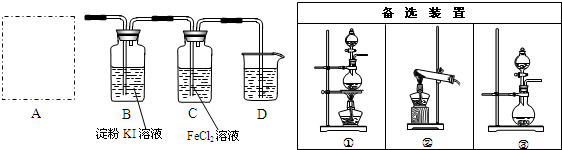
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X2Y3 | B. | XY3 | C. | X2Y4 | D. | X3Y |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com