
| A. | 将草木灰和硫铵混合使用,相当于施用了氮和钾的复合肥料,提高了肥料利用率 | |
| B. | 铝制容器不能长期盛装酸性或碱性食品,但可用于长期盛放腌制食品 | |
| C. | 氟里昂(CCl2F2)或NOx都可以破坏臭氧层,从而导致了“温室效应” | |
| D. | 大量使用含磷洗涤剂,可导致水体富营养化 |
科目:高中化学 来源: 题型:选择题
| A. | 该电池Zn为负极,ZnO为正极,MnO2为催化剂 | |
| B. | 导电时外电路电子由Zn流向MnO2,内电路电子由MnO2流向Zn | |
| C. | 该电池的正极反应为:MnO2+e-+H2O=MnO(OH)+OH- | |
| D. | 电池工作时正极发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )
利用反应6NO2+8NH3=7N2+12H2O构成电池的装置如图所示.此方法既能实现有效清除氮氧化物的排放,减轻环境污染,又能充分利用化学能.下列说法正确的是( )| A. | 电流从左侧电极经过负载后流向右侧电极 | |
| B. | 为使电池持续放电,离子交换膜需选用阴离子交换膜 | |
| C. | 电极A极反应式为:2NH3-6e-=N2+6H+ | |
| D. | 当有4.48LNO2被处理时,转移电子数为0.8NA |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
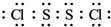 ;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.
;该物质遇水剧烈反应,产生有刺激性气味的混合气体X和Y,同时还有固体单质产生,是已知X能使品红溶液褪色的气体,Y在标准状态下的密度为1.63g/L,该混合气体相对于H2的密度为21,上述过程对应的化学方程式为2S2Cl2+2H2O=SO2↑+4HCl+3S↓;某研究小组同学为确定干燥的X和Y混合气体中Y的存在,设计方案如下:把干燥的X和Y与干燥的NH3混合,出现白烟,则证明有Y气体,你认为此方案正确(填“正确”或“不正确”),理由是干燥的二氧化硫不与氨气反应,但干燥的氯化氢与氨气反应生成白烟.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
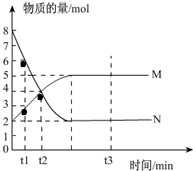 一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:
一定温度下,在容积为V L的密闭容器中进行反应:aN(g)?bM(g),M、N的物质的量随时间的变化曲线如图所示:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
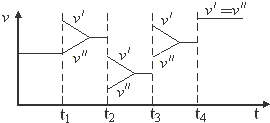
| A. | t1时改变的条件是增大体系的压强 | B. | t2时改变的条件是减小压强 | ||
| C. | t3时改变的条件是升高温度 | D. | t4时改变的条件是使用了催化剂 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 晶体 | NaCl | KCl | CaO |
| 晶格能/(Kj.mol-1) | 786 | 715 | 3401 |

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )
酸碱中和滴定是最基本的定量分析化学实验.常温下,向50mL 0.5mol•L-1 HA溶液中逐滴加入0.5mol•L-1强碱 MOH溶液,图中所示曲线表示混合溶液的pH变化情况(体积变化忽略不计).下列叙述正确的是( )| A. | 由图中信息可知 HA为强酸,N点为恰好中和 | |
| B. | 常温下一定浓度的 MA稀溶液的pH<7 | |
| C. | K点所对应的溶液中离子浓度的大小关系:c(M+)>c(OH-)>c(A-)>c(H+) | |
| D. | K点对应的溶液中,溶液的pH>13,c(HA)+c(A-)=0.25mol•L-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com