
 通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.
通过海水能获得淡水、食盐、镁等,食盐可进一步用于氯碱工业.请回答下列问题.
| ||
| ||


科目:高中化学 来源: 题型:

| A、用装置甲收集CH4,采取b端进气a端出气的方式 |
| B、用装置乙收集NO2气体 |
| C、用装置丙吸收NH3 |
| D、用仪器丁准确量取25.00mL酸性KMnO4溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、石英只能用于生产光导纤维 |
| B、从海水提取物质都必须通过化学反应才能实现 |
| C、为了增加食物的营养成分,可以大量使用食品添加剂 |
| D、淀粉、纤维素和脂肪在一定条件下都可以发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:
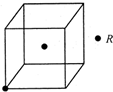 现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.
现有X、Y、Z、W、R五种元素,其中前四种为短周期主族元素.X原子的最外层电子数是核外电子层数的3倍,Y的最高正价与最低负价的代数和为6;X、Z同主族,W与X、Y均不同周期,R2+的价电子排布式为3d5.查看答案和解析>>
科目:高中化学 来源: 题型:
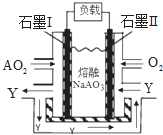 A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:
A、B、C、D、E为原子序数依次增大的元素,其中只有E不属于短周期,相关信息如下表:| 元素 | A | B | C | D | E |
| 相关 信息 |
最高正价与最低负价代数和为2 | 与元素C可形成离子个数比为2:1和1:1的化合物 | 单质质软,通常保存在煤油中 | D元素可形成两种氧化物,其中一种是形成酸雨的主要成分 | 其单质是用途最广泛的金属,人体缺少该元素易患贫血症 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
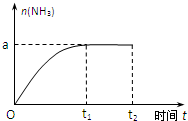 已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.
已知N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ?mol-1.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2O和Na2O2的混合物共1mol,阴离子数目为NA |
| B、过量的Fe与Cl2反应生成0.1mol产物时失去的电子数为0.2NA |
| C、标准状况下,11.2 L CHCl3中含有C-Cl键的数目为1.5NA |
| D、一定条件下,2mol H2和0.5mol N2充分反应后可得到NH3分子数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
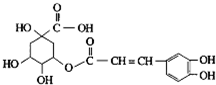 金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )
金银花有效活性成分为绿原酸,又名咖啡鞣酸,具有广泛的杀菌消炎功效,结构如图所示,下列有关绿原酸的说法正确的是( )| A、绿原酸的分子式为C16H8O9 |
| B、1mol绿原酸最多与4mol NaOH反应 |
| C、1个绿原酸分子中含有4个手性碳原子 |
| D、绿原酸分子中有4种化学环境不同的氢原子 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com