
 ��������ʮ�����ʣ���H2 ���� ��CaO ��CO2 ��H2SO4 ��Ba��OH��2
��������ʮ�����ʣ���H2 ���� ��CaO ��CO2 ��H2SO4 ��Ba��OH��2| ����� | �������� | ������ | ��Һ | ����� |
| ���ڸ�������� |
���� ��1������Ԫ����ɵĵ���Ϊ�������ʣ�����Ԫ���������һ��Ϊ��Ԫ�صĻ�����Ϊ����������ܽ����ܼ����γɵķ�ɢϵΪ��Һ�������Ϊˮ��Һ�л�����״̬�ܵ���Ļ����
��2��Al2��SO4��3���������ˮ������Ӧ����������������������泥�
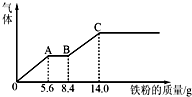
��3����ͼ���֪��������������OA�η�����ӦΪ��Fe+NO3-+4H+=Fe3++NO��+2H2O��AB�η�����ӦΪ��Fe+2Fe3+=3Fe2+��BC�η�����ӦΪ��Fe+2H+=Fe2++H2����
��4�����ݵ�ϡ��Һ��εμӵ�������������������������壬�ȳ��ֽ���۳������������������������������������ܽ⣻
��� �⣺��1������Ԫ����ɵĵ���Ϊ�������ʣ����� ���ڽ������ʣ�
����Ԫ���������һ��Ϊ��Ԫ�صĻ�����Ϊ�������CaO ��CO2�����������
�����ܽ����ܼ����γɵķ�ɢϵΪ��Һ���ఱˮ�͢�ϡ����������Һ��
�����Ϊˮ��Һ�л�����״̬�ܵ���Ļ������CaO����H2SO4����Ba��OH��2 ����Al2��SO4��3
���ڵ���ʣ�
�ʴ�Ϊ��
| �� | �ۢ� | ��� | �ۢݢޢ� |
���� ���⿼�������ʷ�������������ʵ�����Ӧ�ã�ͼ������жϣ���Ҫ������ͼ��Ķ������㣬���ո���ʵ�ʣ�ͼ��Ӧ�����ǽ���ؼ�����Ŀ�Ѷ��еȣ�


 ������ѧ���̲���ȫ���ϵ�д�
������ѧ���̲���ȫ���ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ���ѡ��
| A�� | ˮٶ������Ϊ����ʳ�ø���������ͱ������ɵ����Թ��ж� | |
| B�� | ˮٶ���dz���ʳ�ú��ӵ���ˮ��ȵ�ˮ����ɵ� | |
| C�� | �ձ���ˮٶ�����л�������Ĺ��ж� | |
| D�� | ���������ؽ������ӵĸ���Ũ�ȴ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | �Ȼ��� | B�� | ������̼ | C�� | �������� | D�� | �������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | N2��NO2���۳���ú�� | B�� | CO2��O2�����������̼�⻯���� | ||
| C�� | Cl2��N2��ú�̡����������� | D�� | H2S��SO2���۳���ú�̡����������� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
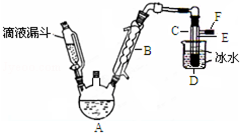 ��ͼ��ʵ�������Ҵ���Ũ������廯�Ʒ�Ӧ���Ʊ��������װ�ã���Ӧ��Ҫ���ȣ�ͼ��ʡȥ�˼���װ�ã��й����ݼ�����
��ͼ��ʵ�������Ҵ���Ũ������廯�Ʒ�Ӧ���Ʊ��������װ�ã���Ӧ��Ҫ���ȣ�ͼ��ʡȥ�˼���װ�ã��й����ݼ�����| �Ҵ� | ������ | �� | |
| ״̬ | ��ɫҺ�� | ��ɫҺ�� | �����ɫҺ�� |
| �ܶ�/g•cm-3 | 0.79 | 1.44 | 3.1 |
| �е�/�� | 78.5 | 38.4 | 59 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
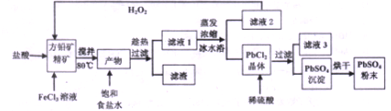
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
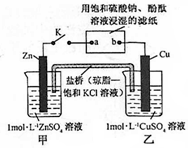
| A�� | Ƭ�̺�׳���c��SO42-������ | B�� | ������ Zn��a��b��Cu ·������ | ||
| C�� | Cu �缫�Ϸ�����ԭ��Ӧ | D�� | Ƭ�̺�ɹ۲쵽��ֽb����ɫ |
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com