
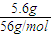 =0.1mol,则消耗硫酸为0.1mol,生成硫酸亚铁、氢气均为0.1mol,结合v=
=0.1mol,则消耗硫酸为0.1mol,生成硫酸亚铁、氢气均为0.1mol,结合v=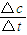 计算.
计算.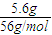 =0.1mol,
=0.1mol,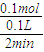 =0.5 mol/(L.min),故B错误;
=0.5 mol/(L.min),故B错误;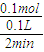 =0.5 mol/(L.min),故D正确;
=0.5 mol/(L.min),故D正确;

 中考解读考点精练系列答案
中考解读考点精练系列答案科目:高中化学 来源: 题型:
5.6g铁粉投入到足量的100mL 2mol/L的稀硫酸的烧杯中,2 min时铁粉刚好溶解,下列表示这个反应的速率正确的是( )
A.v(Fe) = 0.5 mol/(L?min) B.v(H2SO4)= 1 mol/(L?min)
C.v(H2) = 0.5 mol/(L?min) D.v(FeSO4)= 0.5 mol/(L?min)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com