
| A. | ①②③④ | B. | ①③④⑤ | C. | ②③④⑥ | D. | ①③④ |
分析 使紫色石蕊溶液变红,说明水溶液呈酸性,溶液褪色说明具有漂白性,以此解答.
解答 解:①Cl2与水反应生成HCl、HClO,能使紫色石蕊试液由紫变红又褪色,故选;
②盐酸为酸溶液,只能使紫色石蕊试液由紫变红,故不选;
③氯水中含HCl、HClO,能使紫色石蕊试液由紫变红又褪色,故选;
④盐酸酸化的漂白粉溶液,发生强酸制取弱酸的反应生成HClO,含HCl、HClO,能使紫色石蕊试液由紫变红又褪色,故选;
⑤Na2O2与水反应生成氢氧化钠,溶液呈碱性,可使紫色石蕊变蓝,故不选;
⑥木炭具有吸附性,不具有酸性,不能使紫色石蕊试液由紫变红,故不选;
故选D.
点评 本题考查较为综合,涉及过氧化钠、盐酸、HClO和氯气的性质,侧重于学生的分析能力和元素化合物知识的综合理解和运用的考查,注意相关基础知识的积累,难度不大.


 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案科目:高中化学 来源: 题型:推断题
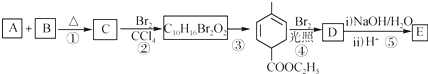
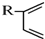 +
+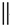 $\stackrel{△}{→}$
$\stackrel{△}{→}$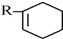
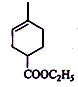 +Br2→
+Br2→ .
.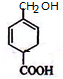 .
.查看答案和解析>>
科目:高中化学 来源: 题型:推断题
 根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.
根据如图反应框图填空.已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应.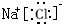
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
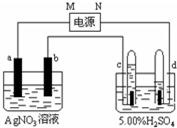 如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.试管充满水,通电一段时间后,在c、d两极上共收集到标准状态下336mL气体,体积如图所示.请回答下列问题.
如图中电极a、b分别为Ag电极和Pt电极,电极c、d都是石墨电极.试管充满水,通电一段时间后,在c、d两极上共收集到标准状态下336mL气体,体积如图所示.请回答下列问题.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,28g氮气的体积约为22.4升 | |
| B. | 标准状况下,11.2L水含有1mol氢原子 | |
| C. | 标准状况下,11.2L氧气与硫充分反应,转移的电子数目为2NA | |
| D. | 常温常压下,1mol氯气完全被碱吸收需要NA个氢氧根离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,2.24 L H2O中所含的原子总数为0.3NA | |
| B. | 0.1 molCl2与足量的NaOH稀溶液反应,转移的电子总数为0.2NA | |
| C. | 1mol•L一1的NaCl溶液中所含Na+数目为NA | |
| D. | 常温常压下,14g由N2和CO组成的混合气体中含有的原子总数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
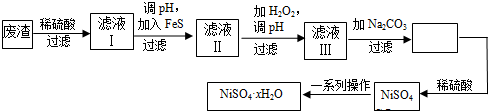
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| ① | ② | ③ | 实验结论 |  | |
| A. | 硫酸 | Na2SO3 | KMnO4 | SO2有漂白性 | |
| B. | Br2的苯溶液 | 铁屑 | AgNO3 | 苯和溴单质在铁催化剂作用下发生取代反应 | |
| C. | H2O | 工业电石 | KMnO4 | 乙炔具有还原性 | |
| D. | 硫酸 | Na2CO3 | Na2SiO3 | 非金属性:S>C>Si |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com