
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小,但还是中性 | |
| C. | 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |
分析 水的电离平衡:H2O?H++OH-中,要使平衡发生移动,应改变溶液c(H+)或c(OH-)的浓度,水的电离是吸热过程,升高温度,平衡向电离方向移动,K增大,c(H+),则pH减小.Kw随温度变化,以此解答该题.
解答 解:A.温度不变,水的离子积常数不变,与溶液的酸碱性无关,故A错误;
B.水的电离是吸热反应,升高温度促进水电离,离子积常数增大,氢离子浓度增大,溶液的pH减小,但还是中性,故B正确;
C.CH3COONa是强碱弱酸盐,在溶液能结合水电离出氮气氢离子从而使水的电离被促进,故向水中加入醋酸钠固体,促进水电离,平衡正向移动,氢离子浓度减小,故C错误;
D.AlCl3是强酸弱碱盐,在水溶液中能结合水电离出的氢氧根而水解,从而对水的电离有促进作用,即水的电离向右移,但由于温度不变,故Kw不变,故D错误.
故选B.
点评 本题考查水的电离平衡移动,为高频考点,侧重于学生的分析能力的考查,题目难度不大,注意从浓度、温度对平衡移动的影响角度分析,本题易错点为B,注意升高温度c(H+)增大,pH减小.Kw增大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 其化学式改写为氧化物的形式为2CaO•3MgO•Fe2O3•8SiO2•H2O | |
| B. | 它能够抵抗任何酸碱的腐蚀 | |
| C. | 其中铁元素的化合价为+3 | |
| D. | 其中铁元素的化合价为+2 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)A的摩尔质量为:90. |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)A的分子式为 :C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (3)A中含有官能团的名称: 羧基、羟基. |
(4)A的核磁共振氢谱如图: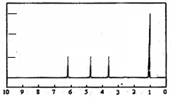 | (4)A中含有1个手性碳原子. |
(5)综上所述,A的结构简式为: . . | |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加压 | B. | 减压 | C. | 降温 | D. | 减少E的浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | PH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 由水电离出的C(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 无色溶液中:Cu2+、Al3+、NH4+、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、AlO2-、S2- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
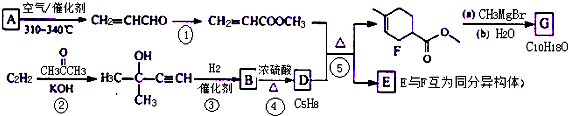
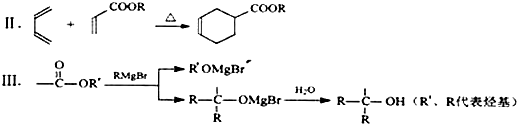
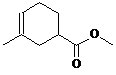 、
、
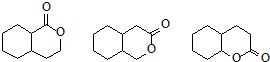 (其中任意一种).
(其中任意一种).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+ | B. | SO42- | C. | S 2- | D. | NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 微热 | B. | 加入适量氧化铜 | ||
| C. | 加入少量硫酸铜溶液 | D. | 加水 | ||
| E. | 加入少量氢氧化钡溶液 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com