
【题目】有下列六种物质:①Na2O ②Na2O2 ③NaCl ④Na2CO3溶液 ⑤NaOH溶液 ⑥NaHCO3溶液。其中不能与CO2反应的是( )
A. ①④ B. ②③ C. ③⑥ D. ⑤⑥
 举一反三同步巧讲精练系列答案
举一反三同步巧讲精练系列答案 口算与应用题卡系列答案
口算与应用题卡系列答案科目:高中化学 来源: 题型:
【题目】某工厂的工业废水中含有大量的FeSO4 , 较多的CuSO4和少量Na2SO4 . 为了减少污染并变废为宝,工厂计划从该废水中回收硫酸亚铁和金属铜.请根据下列流程图,完成回收硫酸亚铁和铜的实验方案.(可供选择的试剂为铁粉、稀H2SO4、NaOH溶液等试剂) 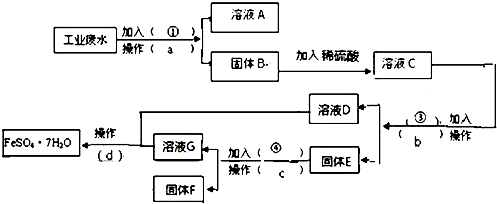
(1)操作a的名称为 , 所需要的玻璃仪器为 .
(2)固体E的成分为 , 加入的试剂④为 , 发生的化学方程式为 .
(3)加入试剂①的目的是 .
(4)从溶液D和溶液G中得到FeSO4.7H2O晶体的操作为、冷却结晶、、洗涤、干燥.
(5)若废水中硫酸亚铁、硫酸铜和硫酸钠组成的混合溶液,其中c(Cu2+)=0.1mol/L,c(Fe2+)=0.4mol/L,c(SO ![]() )=0.6mol/L,已知氢离子浓度忽略不计,则c(Na+)为 .
)=0.6mol/L,已知氢离子浓度忽略不计,则c(Na+)为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,则下列说法中正确的是( )
A.80g硝酸铵含有氮原子数为2NA
B.标准状况下,22.4L CCl4所含分子数目为NA
C.常温常压下,32 g的O2和O3混合气体含有的原子数为2NA
D.8.4gNaHCO3溶解于水,电离生成的CO ![]() 数目为0.1NA
数目为0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂.关于维生素P的叙述正确的是( ) 
A.若R为甲基则该物质的分子式可以表示为C16H10O7
B.分子中有三个苯环
C.lmol该化合物与NaOH溶液作用消耗NaOH的物质的量以及与氢气加成所需的氢气的物质的量分别是4 mol、8 mol
D.lmol该化合物最多可与7molBr2完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲是一种可用于净水和膨化食品的盐,由A,B,C,D,E五种短周期元素组成.甲溶于水后可电离出三种离子,其中一种是由A、B形成的10电子阳离子.A元素原子核内质子数比E的少l,D,E同主族.某同学为探究甲的组成而进行如下实验:
①取mg甲的晶体溶于蒸馏水,配成500mL溶液;
②取少量甲溶液于试管中,逐滴滴入Ba(OH)2溶液,生成沉淀的物质的量与滴入Ba(OH)2溶液体积的关系如图所示;
③取20mL甲溶液于试管中,加入过量NaOH溶液后加热并收集产生的气体,然后折算成标准状况下的体积为224mL.
回答下列问题:
(1)D在元素周期表中的位置为 .
(2)经测定晶体甲的摩尔质量为453gmol﹣1 , 其中阳离子和阴离子物质的量之比为1:1. 则晶体甲的化学式为 .
(3)图象中V(Oa):V(ab):V(bc)= 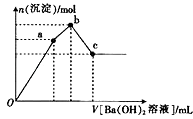
(4)写出ab段发生反应的离子方程式: .
(5)配成的甲溶液物质的量浓度是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据所学知识,完成下面题目:
(1)同温、同压下等质量的SO3和NO2 , 它们所占的体积比为 , 所含氧元素的物质的量之比为 .
(2)2molO2与1molO3的摩尔质量的比是 .
(3)某化合物的相对分子质量为m,在t℃时A ml该化合物的饱和溶液为B g,将其蒸干后得到固体C g.该化合物在t℃时的溶解度为g,该饱和溶液中溶质的物质的量浓度为mol/L.
(4)实验室制取氯气的化学方程式为:4HCl(浓)+MnO2 ![]() Cl2↑+MnCl2+2H2O, 请回答:MnO2与被氧化的HCl的物质的量之比是;用单线桥法标出电子转移的方向和数目: .
Cl2↑+MnCl2+2H2O, 请回答:MnO2与被氧化的HCl的物质的量之比是;用单线桥法标出电子转移的方向和数目: .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大.A的核外电子总数与其电子层数相同,b的价电子层中的未成对电子有3个,c的最外层电子数为其内层电子数的3倍,d与c同主族,e的最外层只有1个电子,但次外层有18个电子.回答下列问题:
(1)b、c、d中第一电离能最大的是(填元素符号),e的价层电子轨道示意图为 .
(2)a和其他元素形成的二元共价化合物中,分子呈三角锥形,该分子的中心原子的杂化方式为;分子中既含有极性共价键,又含有非极性共价键的化合物是(填化学式,写两种).
(3)这些元素形成的含氧酸中,分子的中心原子的价层电子对数为3的酸是;酸根呈三角锥结构的酸是 . (填化学式)
(4)c和e形成的一种离子化合物的晶体结构如图1,则e离子的电荷为 .
(5)这5种元素形成的一种1:1型离子化合物中,阴离子呈四面体结构,阳离子呈轴向狭长的八面体结构(如图2所示).该化合物中阴离子为 , 阳离子中存在的化学键类型有;该化合物加热时首先失去的组分是 , 判断理由是 . 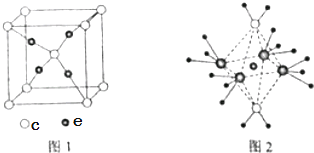
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列事实的解释错误的是( )
A.在蔗糖中加入浓H2SO4后出现发黑现象,说明浓H2SO4具有脱水性。
B.浓H2SO4和浓HCl混合可制得氯化氢,说明浓H2SO4是一种难挥发的酸。
C.常温下,浓硫酸可以用铝罐贮存,说明铝与浓H2SO4不反应。
D.反应CuSO4+H2S = CuS↓+H2SO4能进行,说明CuS既不溶于水,也不溶于硫酸。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com