
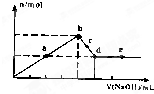
 向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是
向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是

 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
| 实验 | 实验目的 | 实验内容 |
| Ⅰ | 探究Mg、Al的金属性强弱 | 1将除去氧化膜的镁条和铝条分别投入稀盐酸中 2将除去氧化膜的镁条和铝条分别放入试管中,加入 少量水,加热至沸腾,再向溶液中滴加酚酞溶液 3向MgCl2和AlCl3溶液中分别加氨水至过量 |
| Ⅱ | 探究Cl、S的非金属性强弱 | ④分别加热密封于玻璃管中的H2S和HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:
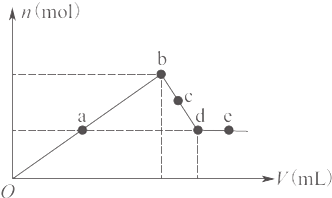 向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )
向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是( )| A、a、c两点沉淀物成分相同,d、e两点沉淀物成分相同 | B、在反应过程中,各状态点溶液的pH大小顺序是:e>d>c>a>b | C、b-c段与c-d段溶液中阴离子的物质的量相等 | D、在d点,向溶液中逐滴加入盐酸,沉淀量将减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:

(1)向石灰水中通入二氧化碳_________。
(2)向氯化铝溶液中滴入NaOH溶液_________。
(3)向偏铝酸钠溶液中加入稀盐酸_________。
(4)向盐酸和氯化铝混合溶液中逐滴加入氢氧化钠溶液_________。
(5)向MgCl2和AlCl3混合液中加入过量的NaOH溶液_________。
(6)向MgCl2和AlCl3混合液中先加NaOH溶液后,至沉淀不再溶解,加HCl溶液_________。
(7)向AlCl3溶液中加氨水_________。
(8)向NaAlO2溶液中通入CO2气体_________。
(9)向KAl(SO4)2中滴加Ba(OH)2_________。
(10)向Al2(SO4)3中滴加NaAlO2溶液_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
如图所示,横坐标表示通入气体或加入试剂的体积,纵坐标表示产生沉淀的物质的量。适合下列各种情况的分别填入该题后(填图的字母代码)。

(1)向石灰水中通入二氧化碳_________。
(2)向氯化铝溶液中滴入NaOH溶液_________。
(3)向偏铝酸钠溶液中加入稀盐酸_________。
(4)向盐酸和氯化铝混合溶液中逐滴加入氢氧化钠溶液_________。
(5)向MgCl2和AlCl3混合液中加入过量的NaOH溶液_________。
(6)向MgCl2和AlCl3混合液中先加NaOH溶液后,至沉淀不再溶解,加HCl溶液_________。
(7)向AlCl3溶液中加氨水_________。
(8)向NaAlO2溶液中通入CO2气体_________。
(9)向KAl(SO4)2中滴加Ba(OH)2_________。
(10)向Al2(SO4)3中滴加NaAlO2溶液_________。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年安徽省高三上学期第三次段考化学试卷 题型:选择题
向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如下图所示。
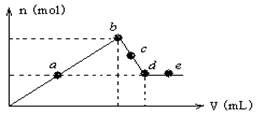
则下列说法正确的是( )
A.a、c两点沉淀物成份相同,d、e两点沉淀物成份相同
B. b—c段与c—d段溶液中阴离子的物质的量相等
C.在d点,向溶液中加入盐酸,沉淀量将减少
D.在反应过程中,各状态点溶液的pH大小顺序是:e > d > c > a > b
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com