
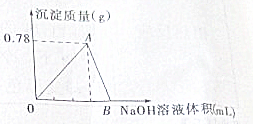
 向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:
向20mL AlCl3溶液中滴入2mol?L-1 NaOH溶液时,沉淀质量与所滴加NaOH溶液体积(mL)关系如图所示:| n |
| c |
| 0.39g |
| 78g/mol |
| 0.015mol |
| 2mol/L |
| 0.035mol |
| 2mol/L |


科目:高中化学 来源: 题型:
| A、标准状况下,22.4LH2O含有的分子数为1 NA |
| B、常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA |
| C、通常状况下,60 g SiO2晶体中含有SiO2分子数为1 NA |
| D、物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 如图所示,若电解5min时铜电极质量增加2.16g,试回答:
如图所示,若电解5min时铜电极质量增加2.16g,试回答:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 实验是化学的最高法庭.以镁条、铝片为电极,以NaOH稀溶液为电解质溶液构成原电池,人们普遍认为铝是负极. 某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:
实验是化学的最高法庭.以镁条、铝片为电极,以NaOH稀溶液为电解质溶液构成原电池,人们普遍认为铝是负极. 某研究性学习小组为探究该原电池究竟谁是负极,发生怎样的电极反应,进行了如下实验:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:

| 成分 | 质量(g) | 摩尔质量(g?mol-1) |
| 蔗糖 | 68.4 | 342 |
| 硫酸钾 | 0.50 | 174 |
| 阿司匹林 | 0.35 | 180 |
| 高锰酸钾 | 0.50 | 158 |
| 硝酸银 | 0.04 | 170 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com