
【题目】黄铜是由铜和锌组成的合金,在黄铜中加入镍可显著提高黄铜在大气中和海水中的耐蚀性。回答下列问题:
(1)基态Ni2+的核外电子排布式为____________________,有_______个未成对电子。
(2)CuSO4溶液里逐滴滴入过量氨水,形成深蓝色溶液。
①深蓝色的溶液 是因为生成了一种配离子,其离子符号为____________________
其中配位原子是____________ 。
②NH3分子的空间构型是_______。NH3的键角______(填大于或小于)H2O,原因是__________。
【答案】 1s22s22p63s23p63d8 2 [Cu(NH3)4]2+ N 三角锥形 大于 氨分子和水分子的VSEPR模型都是四面体形,但水分子中中心原子孤电子对数大于氨分子,对σ键的斥力更大,键角更小
【解析】(1)Ni原子核外有28个电子,根据构造原理,基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2,Ni2+的核外电子排布式为1s22s22p63s23p63d8。有2个未成对电子。
(2)CuSO4溶液中逐滴滴入过量氨水,发生的离子反应有:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
①配离子符号为[Cu(NH3)4]2+,配位原子为N。
②NH3分子的空间构型为三角锥形。NH3的键角大于H2O,原因是:氨分子和水分子的VSEPR模型都是四面体形,但水分子中中心原子孤电子对数大于氨分子,对σ键的斥力更大,键角更小。
(1)Ni原子核外有28个电子,根据构造原理,基态Ni原子的核外电子排布式为1s22s22p63s23p63d84s2,Ni2+的核外电子排布式为1s22s22p63s23p63d8。3d原子轨道中有2个未成对电子。
(2)CuSO4溶液中逐滴滴入过量氨水,发生的离子反应有:Cu2++2NH3·H2O=Cu(OH)2↓+2NH4+、Cu(OH)2+4NH3·H2O=[Cu(NH3)4]2++2OH-+4H2O。
①配离子符号为[Cu(NH3)4]2+,NH3分子中N原子提供孤电子对与Cu2+的空轨道共用,配位原子为N。
②NH3中中心原子N上的孤电子对数为![]() (5-3
(5-3![]() 1)=1,成键电子对数为3,价层电子对数为1+3=4,VSEPR模型为四面体形,略去N上的一对孤电子对,NH3分子的空间构型为三角锥形。NH3的键角大于H2O,原因是:氨分子和水分子的VSEPR模型都是四面体形,但水分子中中心原子孤电子对数[H2O中中心原子O上的孤电子对数为
1)=1,成键电子对数为3,价层电子对数为1+3=4,VSEPR模型为四面体形,略去N上的一对孤电子对,NH3分子的空间构型为三角锥形。NH3的键角大于H2O,原因是:氨分子和水分子的VSEPR模型都是四面体形,但水分子中中心原子孤电子对数[H2O中中心原子O上的孤电子对数为![]() (6-2
(6-2![]() 1)=2]大于氨分子,对σ键的斥力更大,键角更小。
1)=2]大于氨分子,对σ键的斥力更大,键角更小。


 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案 小博士期末闯关100分系列答案
小博士期末闯关100分系列答案科目:高中化学 来源: 题型:
【题目】将3.72g金属钠、氧化钠和过氧化钠的混合物与足量水反应,在标准状况下得到672mL混合气体,将混合气体电火花点燃,恰好完全反应,则原混合物中钠、氧化钠、过氧化钠的物质的量之比为( )
A. 3:2:1 B. 4:2:1 C. 2:1:1 D. 1:1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.Fe(OH)3胶体可以透过滤纸B.氯化钠溶液可以产生丁达尔效应
C.BaSO4为强电解质D.强电解质的导电能力一定比弱电解质的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①为纪念著名天文学家哥白尼,国际纯粹与应用化学联合会将112号元素的符号定为“Cn”,汉语名为“鎶”;②合理利用核能符合“低碳经济”的要求,![]() 是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6和少量钙、镁杂质)。下列有关对上述表述所涉及元素的说法正确的是( )
是核反应堆的重要原料;③锂被誉为“高能金属”,制取锂的原料是β锂辉矿(主要成分是LiAlSi2O6和少量钙、镁杂质)。下列有关对上述表述所涉及元素的说法正确的是( )
A. ![]() 的原子核内中子数与核外电子数之差为55
的原子核内中子数与核外电子数之差为55
B. ![]() 和
和![]() 是同位素,核反应属于化学变化
是同位素,核反应属于化学变化
C. 40Ca2+与18O22-具有相同的电子数
D. Si2O64-中质子总数为80
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
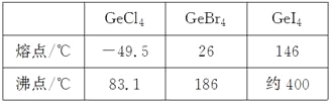
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。

②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧元素有三种同位素,18O是氧的一种核素,下列说法正确的是
A. 18O原子所含质子数为18
B. 1mol 的1H218O分子所含中子数约为12NA个
C. 3.6g 的18O2气体的体积约为2.24 L
D. 18O2气体的摩尔质量为36 g/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溶液中的化学反应大多是离子反应。根据要求回答下列问题:
(1)盐碱地(含较多Na2CO3、NaCl)不利于植物生长,试用离子方程式表示:盐碱地产生碱性的原因:__________________________________________;
(2)已知水存在如下平衡:H2O+H2O![]() H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
H3O++OH-,向水中加入NaHSO4固体,水的电离平衡向________移动,且所得溶液显________性。
(3)若取pH、体积均相等的NaOH溶液和氨水分别用水稀释m倍、n倍,稀释后pH仍相等,则m________n (填“>”“<”或“=”)。
(4)常温下,在pH=6的CH3COOH与CH3COONa的混合溶液中水电离出来的c(OH-)=________。
(5)已知:常温下,醋酸和NH3·H2O的电离平衡常数均为1.74×10-5;则 NH4HCO3溶液呈________性,NH4HCO3溶液中物质的量浓度最大的离子是________(填化学式)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com