
碲(Te)为第VIA元素.其单质和化合物在化工生产等方面具有重要应用。
(1)TeO2微溶于水,易溶于较浓的强酸和强碱。与盐酸反应时生成四氯化碲,其化学方程式为________________。
(2)25℃时;亚碲酸(H2TeO3)的 Ka1=1×10-3,Ka2=2×10-8。该温度下,0.1mol·L-1 H2TeO3的电离度α约为______________(α= ×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
×100%);NaHTeO3溶液的pH__________7(填“ >”、“<”或“=”)。
(3)工业上常用铜阳极泥(主要成分为Cn2Te,还含有少量的Ag、Au)为原料制备单质碲,其工艺流程如下:
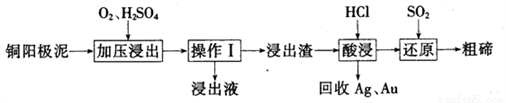
①实验室进行操作I时,下列仪器与该实验操作无关的为__________(填选项字母)。
A.长颈漏斗 B.烧杯 C.锥形瓶 D .玻璃棒
②已知‘浸出渣”的主要成分为TeO2。“加压浸出”时控制溶液pH为4.5~5.0,酸性不能过强的原因为_______________;“加压浸出”过程的离子方程式为______________________。
③“酸浸”后将SO2通入浸出液即可制得单质碲,则生成碲的化学方程式为________________。
④工业上还可以将铜阳极泥煅烧、碱浸后得到Na2TeO3,然后通过电解的方法得到单质碲。已知电解时的电极均为石墨,则阴极的电极反应式为___________。
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2017届福建省漳州市八校高三上学期期末联考化学试卷(解析版) 题型:选择题
将一定量的镁和铜组成的混合物加入到稀硝酸中,金属完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1g.下列叙述不正确的是( )
A. 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4mol
B. 参加反应的金属的总质量 3.6g<m<9.6 g
C. 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=100mL
D. 当金属全部溶解时收集到NO气体的体积在标况下为 2.24L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年湖北省宜昌市高二上学期期末考试化学试卷(解析版) 题型:选择题
在50 m L 0.1mol/L Na2S 溶液中逐滴加入50 mL 0.1mol/L KHSO4溶液,所得溶液中粒子浓度关系正确的是
A. c(SO42-)= c(HS-)= c(K+)>c(OH-)= c(H+)
B. c(Na+)> c(K+)> c(S2-)> c(H+)> c(OH-)
C. c(Na+)= c(S2-)+ c(HS-)+ c(H2S)+ c(SO42-)
D. c(K+)+ c(Na+)+ c(H+)= c(SO42-)+ c(S2-)+ c(HS-)+ c(OH-)
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:简答题
镁及其化合物有广泛用途.工业上以菱镁矿(主要成分为MgCO3,含SiO2以及少量FeCO3等杂质)为原料制备纳米氧化镁的实验流程如下
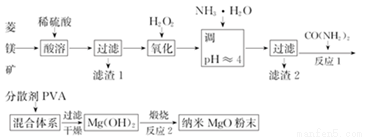
回答下列问题:
(1)滤渣1为____________(填化学式),CO(NH2)2的电子式为______。
(2)在实验室煅烧滤渣2制得的金属氧化物为______(填化学式),需要的仪器除酒精灯、三脚架以外,还需要______(填名称)。
(3)在一定条件下CO(NH2)2可与H2O反应生成CO2和一种弱碱,反应的化学方程式为__________。
(4)室温时,加入CO(NH2)2,产生沉淀。当 Mg2+沉淀完全时,溶液中的c(OH-)=_______(离子浓度小于1.0×10-5 mol•L-1时,即可认为该离子沉淀完全;室温时,Ksp[Mg(OH)2]=1.96×10-11)
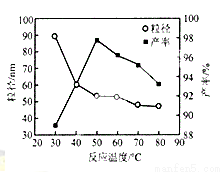
(5)工业上还可用氯化镁和碳酸铵为原料,采用直接沉淀法制务纳米MgO。如图为反应温度对纳米MgO产率和粒径的影响,据图分析反应的最佳温度为__________。
查看答案和解析>>
科目:高中化学 来源:2017届辽宁省庄河市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
X、Y、Z、W均为短周期主族元素,原子序数依次增加,Z是活泼金属元素,Y的最常用单质与Z的单质在适当条件下可按物质的量之比1∶4或1∶2的比例恰好反应生成Q或M,X、W能形成强含氧酸。下列说法错误的是
A. 简单离子半径:Z<Y<X<W B. 气态简单氢化物的稳定性:Y<X
C. Q和M中的阴、阳离子个数比均为1∶2,但化学键种类有差异 D. Z与W能形成ZW或Z2W型离子化合物
查看答案和解析>>
科目:高中化学 来源:2017届河北省高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列实验中,操作和现象均正确且能实现相应实验目的的是
选项 | 实验目的 | 操作 | 现象 |
A | 验证BaSO3难溶于水 | 将SO2通人Ba(NO3)2溶液中 | 有白色沉淀生成 |
B | 验证非金属性:Br>I | 将溴水滴加到淀粉KI溶液中 | 溶液变蓝 |
C | 验证SO2的漂白性 | 将SO2通入酸性KMnO4溶液中 | KMnO4溶液褪色 |
D | 验证某化合物一定是钠盐 | 将该化合物在酒精灯上灼烧 | 焰色为黄色 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源:2016-2017学年甘肃省天水市高二下学期开学考试(寒假作业检测)化学试卷(解析版) 题型:填空题
已知水在25℃和95℃时,其电离平衡曲线如图所示.
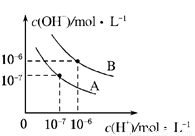
(1)95℃时水的电离平衡曲线应为______(填“A”或“B”),理由是______.
(2)曲线A所对应的温度下,pH=2的HCl溶液和pH=12的某BOH溶液中,若水的电离程度分别用α1、α2表示,则α1______α2(填“大于”、“小于”、“等于”或“无法确定”,下同),若将二者等体积混合,则混合溶液的pH______7.
(3)在曲线B所对应的温度下,将0.02mol•L﹣1的Ba(OH)2溶液与等物质的量浓度的NaHSO4溶液等体积混合,所得混合液的pH=______.
查看答案和解析>>
科目:高中化学 来源:2016-2017学年江西省景德镇市高二(素质班)上学期期末考试化学试卷(解析版) 题型:推断题
石油的裂解是石油化工的重要方法之王,石油的裂解产物是合成材料的重要的基础原料。例如工业上以丙烯为原料可制得一种重要合成橡胶IR和一种合成树脂X。
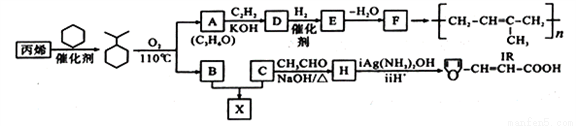
B的分子式是C6H6O,可与NaOH溶液反应。
已知以下信息:
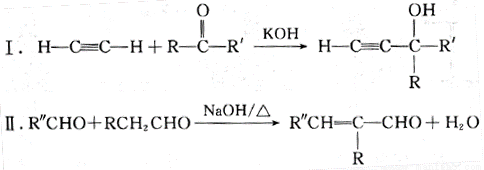
(—R、—R’、—R’’表示可能相同或可能不同的原子或原子团。)
Ⅲ.同一碳原子上有两个碳碳双键时,分子不稳定。
请回答下列问题。
在一定条件下,丙烯可与下列物质反应的是__________。
A、H2O B、NaOH溶液 C、Br2的CCl4溶液 D、酸性KMnO4溶液
(2)A与C2H2合成D的化学方程式是___________________,反应类型是______________。
(3)E、F中均含有碳碳双键,则E的结构简式是_____________。
(4)H的结构简式是_____________。
(5)B与C在一定条件下反应生成合成树脂X的化学方程式是_____________。
(6)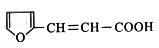 有多种同分异构体,符合下列要求的有___________种,其中在核磁共振氢谱中只出现四组峰的有_________种。
有多种同分异构体,符合下列要求的有___________种,其中在核磁共振氢谱中只出现四组峰的有_________种。
能与FeCl3溶液反应显紫色 ②只能发生银镜反应,不能发生水解反应
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省庄河市高一上学期期末考试化学试卷(解析版) 题型:选择题
将100gNa2CO3和NaHCO3的混合物用酒精灯加热至质量不再变化时,固体质量减少到75.2g。此混合物中Na2CO3的质量分数是( )
A. 75.2% B. 67.2% C. 41.7% D. 32.8%
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com