

 $\stackrel{R′OH}{→}$
$\stackrel{R′OH}{→}$ +
+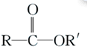
 +RCl→
+RCl→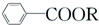 +NaCl
+NaCl .
. +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O.
+H2O. .
.分析 D为苯的同系物,D与氯气反应生成E,E与NaOH的水溶液发生取代反应生成F,F与浓溴水混合不产生白色沉淀,结合E的分子式可推得F为: 、E为
、E为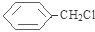 、D为
、D为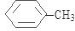 ;根据图示反应①为:
;根据图示反应①为: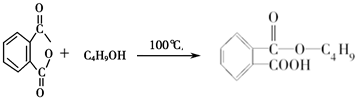 ,是取代反应,则A的结构简式为
,是取代反应,则A的结构简式为 ;反应④为:
;反应④为: +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,是取代反应;控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为
+H2O,是取代反应;控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为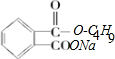 ;B与E(
;B与E( )发生取代反应生成J(
)发生取代反应生成J( ),据此进行解答.
),据此进行解答.
解答 解:D为苯的同系物,D与氯气反应生成E,E与NaOH的水溶液发生取代反应生成F,F与浓溴水混合不产生白色沉淀,结合E的分子式可推得F为: 、E为
、E为 、D为
、D为 ;根据图示反应①为:
;根据图示反应①为: ,是取代反应,则A的结构简式为
,是取代反应,则A的结构简式为 ;反应④为:
;反应④为: +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,是取代反应;控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为
+H2O,是取代反应;控制反应条件,使物质A中的支链Y不与NaOH溶液发生反应,则B为 ;B与E(
;B与E( )发生取代反应生成J(
)发生取代反应生成J( ),
),
(1)根据分析可知,E为 、E中的官能团为氯原子,F的结构简式为:
、E中的官能团为氯原子,F的结构简式为: ,F中官能团为-OH,羟基的电子式为
,F中官能团为-OH,羟基的电子式为 ,
,
故答案为:氯原子; ;
;
(2)A+F→J的化学方程式为 +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O,
+H2O,
故答案为: +
+ $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$ +H2O;
+H2O;
(3)根据上面的分析可知,反应①为取代反应,反应④为取代反应,
故答案为:取代反应;取代反应;
(4)F为: ,F的属于芳香烃衍生物的同分异构体的结构简式为
,F的属于芳香烃衍生物的同分异构体的结构简式为 ,
,
故答案为: ;
;
(5)C4H9OH的同分异构体中属于醇类的有CH3CH2CH2CH2OH、CH3CH2CH(OH)CH3、(CH3)2C(OH)CH3、(CH3)2CHCH2OH,共4种,其中具有手性碳原子的同分异构体的结构简式为:CH3CH2CH(OH)CH3,
故答案为:4;CH3CH2CH(OH)CH3.
点评 本题考查有机合成,题目难度中等,试题涉及有机物的结构、性质、相互转化、官能团的电子式、方程式和同分异构体的书写及通式的含义等知识,熟练掌握常见有机物结构与性质为解答关键,试题培养了学生的分析、理解能力.


 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使高分子材料具有仿生能力 | |
| B. | 使高分子材料向功能材料方向发展 | |
| C. | 使高分子材料越来越牢固,难分解 | |
| D. | 使农用薄膜能够选择性地透过某种植物所需要的特定波长的光 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 +
+ $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$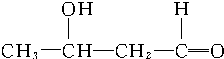
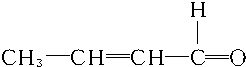 +2H2$→_{△}^{催化剂}$
+2H2$→_{△}^{催化剂}$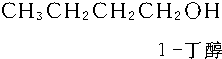
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
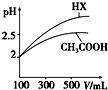 已知25℃时部分弱电解质的电离平衡常数数据如表所示:
已知25℃时部分弱电解质的电离平衡常数数据如表所示:| 化学式 | CH3COOH | H2CO3 | HClO | |
| 电离平衡常数 | Ka=1.8×10-5 | Ka1=4.3×10-7 | Ka2=5.6×10-11 | Ka=3.0×10-8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
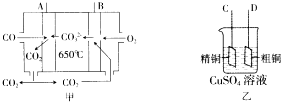 一氧化碳是一种用途十分广泛的化工基础原料.
一氧化碳是一种用途十分广泛的化工基础原料.| 温度 | 250℃ | 300℃ | 350℃ |
| A | 2.041 | 0.250 | 0.012 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | V1:V2的值 | B. | V1和V2的值 | ||
| C. | X和Y的物质的量 | D. | 盐酸和稀硫酸的物质的量浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2,2-二甲基-1-丁烯 | B. | 2,3-二甲基-2-乙基丁烷 | ||
| C. | 3,3,5,5-四甲基己烷 | D. | 2-甲基-1,3-丁二烯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③⑤ | C. | ①②④⑤ | D. | 全部 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com