
分析 (1)根据m=ρV计算溶液的质量,根据m=cVM计算溶质的质量,再根据质量分数公式进行计算;
(2)氯气和氢气生成的氯化氢和氢氧化钠反应生成氯化钠,氯气和氢氧化钠反应生成氯化钠和次氯酸钠,根据原子守恒计算溶液中Cl-与ClO-的物质的量之和;
(3)根据剩余的氯气的物质的量计算次氯酸根离子的物质的量.
解答 解:(1)溶液的质量m=ρV=1.12g/mL×200mL=224g,溶质的质量m=cVM=3.0mol/L×0.2L×40g/mol=24g,所以其质量分数=$\frac{24g}{224g}$=0.107,
答:氢氧化钠溶液的质量分数是0.107;
(2)氯气和氢气生成的氯化氢和氢氧化钠反应生成氯化钠,氯气和氢氧化钠反应生成氯化钠和次氯酸钠,2NaOH+Cl2=NaCl+NaClO+H2O、NaOH+HCl=NaCl+H2O知,n(Cl2)=$\frac{1}{2}$n(NaOH)=$\frac{1}{2}$×3.00mol/L×0.2L=0.3mol,再根据原子守恒知,所得溶液中NaCl与NaClO的物质的量之和=2 n(Cl2)=0.6mol,
答:所得溶液中NaCl与NaClO的物质的量之和为0.6mol;
(3)根据H2+Cl2$\frac{\underline{\;点燃\;}}{\;}$2HCl、2NaOH+Cl2=NaCl+NaClO+H2O、NaOH+HCl=NaCl+H2O知,有一半的氯气和氢氧化钠反应生成氯化钠和次氯酸钠,氯气和氢氧化钠的反应中有一半的氯气生成次氯酸钠,所以一共有$\frac{1}{4}$的氯气生成次氯酸钠,则溶液中NaClO的物质的量=$\frac{1}{4}$n(Cl2)=0.15mol,
答:溶液中NaClO的物质的量是0.15mol.
点评 本题考查了物质的量的有关计算,利用原子守恒、物质间的反应进行计算,难度中等.


科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 该有机物的分子式为C9H11O2N | B. | 能合成高分子化合物 | ||
| C. | 能发生加成反应 | D. | 能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
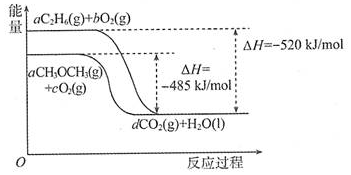
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 油脂能在碱性条件下水解,可用于工业上制取肥皂 | |
| B. | 碘单质易溶于有机溶剂,可用酒精萃取碘水中的碘 | |
| C. | 二氧化锰具有较强的氧化性,可用于H2O2分解的氧化剂 | |
| D. | 聚氯乙烯膜具有塑性和弹性,可用作食品保鲜膜 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
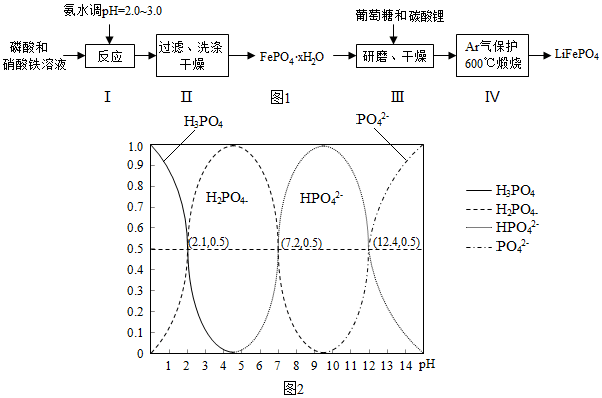
| 实验序号 | 1 | 2 | 3 |
| 固体失重质量分数 | 19.9% | 20.1% | 20.0% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | M、N、Q三种物质的浓度一定相等 | B. | M、N全部变成了Q | ||
| C. | 反应物和生成物的浓度都保持不变 | D. | 正反应和逆反应不再进行 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com