
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 |
| B、配制硫酸亚铁溶液时,需将FeSO4?7H2O先溶于硝酸再用蒸馏水稀释,最后加少量铁粉 |
| C、0.1 mol?L-1Na2CO3溶液加蒸馏水稀释,CO32-的水解程度增大,溶液的pH减小 |
| D、在硫酸钡悬浊液中加入足量饱和Na2CO3溶液处理,向所得沉淀中加入盐酸有气体产生,说明Ksp(BaSO4)>Ksp(BaCO3) |


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
| ||
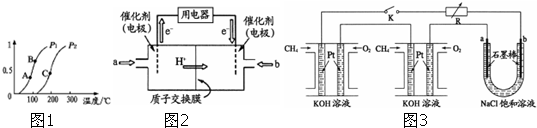
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温常压下,16 g O2含有NA个氧原子 |
| B、1mol苯含有3NA个碳碳单键和3NA个碳碳双键 |
| C、一定条件下,3molH2和1molN2充分反应后,可得到2NA个NH3分子数 |
| D、1 mol?L-1FeCl3溶液中含有Cl-总数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 操作 | 现象 |
 | 现象1:A中溶液变红 现象2:稍后,溶液由红色变为黄色 |
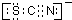 ,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;
,离子反应为:SCN-+8Cl2+9H2O=SO42-+NO3-+16Cl-+18H++CO2;查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Na2SO3与BaCl2溶液作用,有白色沉淀生成,加硝酸后沉淀不消失 |
| B、将SO2气体通入Ba(OH)2溶液中有白色沉淀生成 |
| C、将SO2气体通入BaCl2溶液中有白色沉淀生成 |
| D、将SO2气体通入硝酸酸化的BaCl2溶液中有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、将城市的大型电镀工厂改建在农村,既促进农村经济发展又减轻城市用水污染 | ||||
| B、可吸入颗粒(例如硅酸盐粉尘)形成气溶胶,对人类健康危害极大 | ||||
| C、核裂变是一种化学变化 | ||||
D、核电站泄露的
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2通入CaCl2溶液中 |
| B、NO2通入FeSO4溶液中 |
| C、NH3通入AlCl3溶液中 |
| D、SO2通入已酸化的Ba(NO3)2溶液中 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用10mL量筒量取 5.2mL 盐酸 |
| B、用100mL量筒量取 5.2mL 盐酸 |
| C、用托盘天平称取25.02g NaCl |
| D、用100 mL 容量瓶配制 50 mL 0.1 mol/L 的盐酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com