
下列实验或操作正确的是
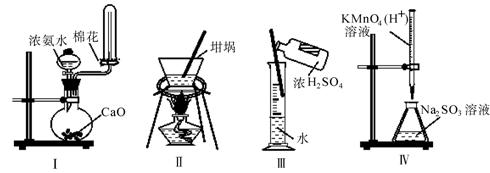
A.实验I:制氨气 B.实验II:蒸发、浓缩、结晶
C.实验III:配制1∶1的稀硫酸 D.实验IV:用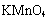 标准溶液滴定未知浓度的Na2SO3溶液
标准溶液滴定未知浓度的Na2SO3溶液
科目:高中化学 来源: 题型:
将250mLH2SO4的质量分数为98%,密度为1.84g/cm3的浓硫酸稀释到1000mL。
(1)稀释前溶液中H2SO4的物质的量浓度是多少?
(2)稀释后溶液中H+的物质的量浓度是多少?
(3 )若要制取3.36LH2 (标准状况),则要用量筒量取稀释后的硫酸溶液多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
(1)肼(N2H4)又称联氨,是一种可燃性的液体,可用作火箭燃料。已知在101kPa时,32.0gN2H4在氧气中完全燃烧生成氮气和水,放出热量624kJ(25℃时),N2H4完全燃烧反应的热化学方程式是 。
(2)肼—空气燃料电池是一种碱性燃料电池,电解质溶液是20%~30%的KOH溶液。
肼—空气燃料电池放电时:
负极的电极反应式是 ;
正极的电极反应式是 。
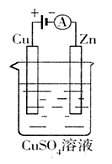 |
(3)下图是一个电化学过程示意图。
①锌片上发生的电极反应是 。
②假设使用肼—空气燃料电池作为本过程中的电源,铜片的质量变化128g,则肼一空气燃料电池理论上消耗标准状况下的空气 L(假设空气中氧气体积含量为20%)
(4)传统制备肼的方法,是以NaClO氧化NH3,制得肼的稀溶液。该反应的离子方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏加德罗常数的值,下列说法正确的是
A.50mL 18.4mol·L-1浓硫酸与足量铜微热反应,生成SO2分子数目为0.46NA
B.常温常压下,4.6gNO2与N2O4混合气中含有0.3NA个原子
C.1L0.1mol·L-1Na2CO3溶液中含有的阴离子数为0.1NA
D.标准状况下,22.4LCCl4中含有NA个分子
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关物质的应用不正确的是
A.碳酸氢钠具有弱碱性,可治疗胃酸过多
B.氧化镁熔点高,可做耐高温材料
C.二氧化硫具有漂白性,可用于漂白纸浆和草帽辫
D.二氧化硅不与强酸反应,可用石英器皿盛放氢氟酸
查看答案和解析>>
科目:高中化学 来源: 题型:
将51.2 g Cu完全溶于适量浓硝酸中,收集到氮的氧化物(含NO、N2O4、NO2)的混合物共0.9 mol,这些气体恰好能被500 mL 2 mol·L-1 NaOH溶液完全吸收,生成含NaNO3和NaNO2的盐溶液。下列说法不正确的是
A.消耗硝酸的物质的量为2.5mol
B.气体中N2O4的物质的量为0.1mol
C.生成NaNO3的物质的量为0.2 mol
D.生成的氮的氧化物的混合气倒置于水槽中,通入标准状况下8.96L O2时,气体完全被吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
今有①CH3COOH;②HCl;③H2SO4三种溶液,选择填空:
A.①>②>③ B.①<②<③ C.①=②=③ D.①=③>②
E.①>②=③ F.①<②=③ G.①=②<③ H.①=②>③
(1)当它们pH相同时,其物质的量浓度关系是 。
(2)体积和物质的量浓度相同的①、②、③三溶液,分别与同浓度的烧碱溶液反应,要使反应后的溶液呈中性,所需烧碱溶液的体积关系为 。
(3)当它们pH相同、体积相同时,分别加入足量锌,相同状况下产生气体体积关系为 。
(4)将pH相同的三种酸均稀释10倍后,pH关系为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
设一个12C原子的质量为a g,一个R原子的质量为b g,阿伏加德罗常数为NA mol-1,则R的相对原子质量可以表示为( )
①12a/b ②12b/a ③bNA ④aNA
A.①③ B.①④
C.②③ D.②④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com