
| A. | 原子半径 A>B>D>C | B. | 原子序数 D>C>B>A | ||
| C. | 离子半径 C>D>B>A | D. | 单质的还原性 A>B>D>C |
分析 已知短周期元素的离子,aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,据此结合元素周期律进行解答.
解答 解:已知短周期元素的离子,aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数A>B>D>C,A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,A、B形成阳离子,则A、B为金属,C、D形成阴离子,则C、D为非金属,
A.A、B处于同一周期,C、D处于同一周期,且A、B处于C、D所在周期的相邻下一周期,同周期,原子序数越大原子半径越小,所以原子半径B>A,C>D,电子层越大原子半径越大,所以原子半径B>A>C>D,故A错误;
B.aA2+、bB+、cC3-、dD- 都具有相同的电子层结构,则离子核外电子数相同,即a-2=b-1=c+3=d-1,原子序数a>b>d>c,故B错误;
C.电子层结构相同,核电荷数越大,离子半径越小,核电荷数A>B>D>C,所以离子半径:C3->D->B+>A2+,故C正确;
D.A、B处于同一周期,A、B形成阳离子,则A、B为金属,原子序数A>B,单质还原性B>A,C、D处于同一周期,C、D形成阴离子,则C、D为非金属,原子序数D>C,单质氧化性D>C,故D错误;
故选C.
点评 本题考查原子结构与元素周期律的关系,题目难度中等,根据核外电子排布确定元素所在周期表中的位置以及把握元素周期律的递变规律是解答该题的关键,试题有利于提高学生的分析能力及逻辑推理能力.


科目:高中化学 来源: 题型:选择题
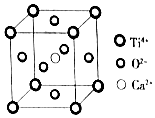
| A. | 该晶体的化学式为CaTiO3 | |
| B. | 该晶体中每个Ti4+和8个O2-相紧邻 | |
| C. | 一个CO2晶胞中平均含有4个CO2分子 | |
| D. | 金属晶体的熔点可能比分子晶体的熔点低 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
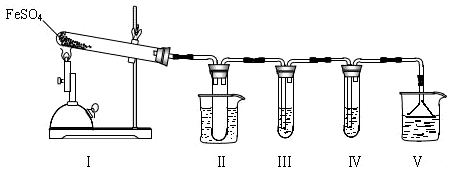
| 检验试剂 | 预期现象和结论 |
| 装置Ⅲ的试管中加入0.5 mol•L -1 BaCl2. | 产生大量白色沉淀,证明气体产物中含有SO3. |
| 装置Ⅳ的试管中加入0.01 mol•L-1 酸性 KMnO4 溶液(或0.0l mol•L-1 溴水). | 若溶液紫色(或橙色)褪去,证明气体产物中含有SO2,若溶液紫色(或橙色)无明显变化,证明气体产物中不含SO2 |

查看答案和解析>>
科目:高中化学 来源: 题型:实验题
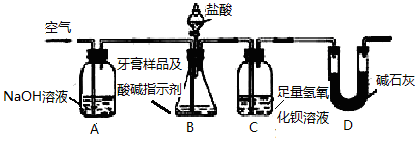
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cl-离子的结构示意图: | B. | HF的电子式: | ||
| C. | 8个中子的碳原子的核素符号:12C | D. | CO2的结构式:O=C=O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 米酒变酸的过程涉及了氧化反应 | |
| B. | 汽油、柴油、植物油都是碳氢化合物 | |
| C. | 3.0 g 甲醛和乙酸的混合物中含有的原子总数为0.6NA | |
| D. | 0.1 mol C2H6O分子中含有C-H键数为0.5NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.15 mol/L的盐酸 | B. | 0.10mol/L的硫酸 | ||
| C. | 0.15 mol/L的醋酸 | D. | 0.10mol/L的氢硫酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com