
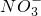 +10H++8e-→N2O+5H2O
+10H++8e-→N2O+5H2O 可知,溶液的体积偏小,浓度偏大,故答案为:大于;
可知,溶液的体积偏小,浓度偏大,故答案为:大于; 来分析;
来分析;

科目:高中化学 来源: 题型:阅读理解
| NO | - 3 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源:2012届山东省济宁市高三上学期期末阶段性教学质量检测化学试卷 题型:实验题
(6分)
(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是 (填写编号)
①精盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)填空:
①读取滴定管中滴体体积时,仰视液面,读取的体积数 实际体积数(填“>”、“=”或“<”)
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量为 g。
③实验需用480mL 0.1mol·L-1NaOH溶液,配制溶液时除需用胶头滴管、烧杯、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是 (填名称),所称取NaOH固体的质量为 g。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年山东省济宁市高三上学期期末阶段性教学质量检测化学试卷 题型:填空
(6分)
(1)玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是 (填写编号)
①精盐提纯
②配制一定物质的量浓度的氯化钠溶液
③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体
④探究Ba(OH)2·8H2O晶体和NH4Cl晶体反应过程中的能量变化
⑤实验室用新制的FeSO4溶液和预处理过的NaOH溶液制备Fe(OH)2白色沉淀
(2)填空:
①读取滴定管中滴体体积时,仰视液面,读取的体积数 实际体积数(填“>”、“=”或“<”)
②用托盘天平称取10.4g食盐,将砝码和食盐的位置颠倒,所称取食盐的质量为 g。
③实验需用480mL 0.1mol·L-1NaOH溶液,配制溶液时除需用胶头滴管、烧杯、托盘天平(带砝码)、玻璃棒、药匙外,还必需用到的仪器是 (填名称),所称取NaOH固体的质量为 g。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com