【答案】
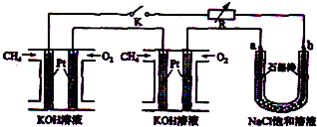
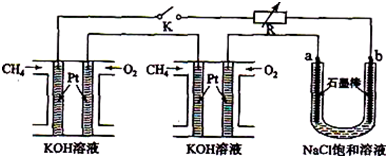
分析:(1)燃料电池中,燃料电极为负极,负极上燃料失电子发生氧化反应,氧化剂电极为正极,正极上氧化剂得电子发生还原反应;
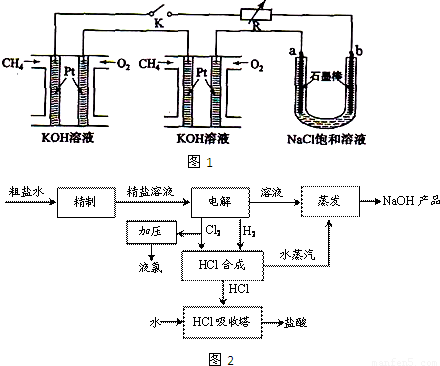
(2)电解氯化钠饱和溶液时,阳极上析出氯气,阴极上析出氢气,同时溶液中生成氢氧化钠;
(3)①根据根据SO
42-、Ca
2+、Mg
2+等易转化为沉淀而被除去,以及根据不能产生新杂质的要求排序,前面加入的过量溶液应用后加入的溶液除去,最后加入适量的溶液;
②电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时阴极上有氢氧根离子生成,根据氢氧根离子浓度的变化判断溶液PH的变化;
③为增大氯气的转化率,过量的气体是氢气;氢气在氯气中燃烧产生苍白色火焰;
④利用HCl合成时放出的热量来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是充分利用能量;
⑤用硝酸酸化的硝酸银溶液检验氯离子.
解答:解:(1)燃料电池中,正极上氧气得电子和水反应生成氢氧根离子,电极反应式为:2O
2+4H
2O+8e
-=8OH
-,负极上甲烷失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为:CH
4+10OH
--8e
-=CO
32-+7H
2O,
故答案为:2O
2+4H
2O+8e
-=8OH
-,CH
4+10OH
--8e
-=CO
32-+7H
2O;
(2)电解饱和氯化钠溶液时,阳极上氯离子放电生成氯气,阴极上氢离子放电生成氢气,同时溶液中产生氢氧化钠,所以电池反应式为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑,
故答案为:2NaCl+2H
2O

2NaOH+H
2↑+Cl
2↑;
(3)①SO
42-、Ca
2+、Mg
2+等分别与BaCl
2溶液、Na
2CO
3溶液、NaOH溶液反应生成沉淀,可再通过过滤除去,Na
2CO
3溶液能除去过量的BaCl
2溶液,盐酸能除去过量的Na
2CO
3溶液和NaOH溶液,所以应先加BaCl
2溶液再加氢氧化钠溶液,或者是先加氢氧化钠溶液再加氯化钡溶液,然后加Na
2CO
3溶液,最后加入盐酸,所以正确顺序为BCDA 或CBDA,
故答案为:BCDA 或CBDA;
②电解饱和食盐水时,与电源正极相连的电极上氯离子失电子发生氧化反应,电极反应式为:发生的反应为2Cl
--2e→Cl
2,阴极上氢离子得电子生成氢气,同时阴极附近生成氢氧根离子,溶液呈碱性,pH变大,
故答案为:2Cl
--2e→Cl
2,变大;
③HCl合成反应中保持过量的气体是氢气,氢气在氯气中燃烧产生苍白色火焰,故答案为:氢气;苍白色火焰;
④利用HCl合成时放出的热量来产生水蒸汽,用于NaOH溶液的蒸发,这样做的优点是充分利用能量,故答案为:充分利用能量;
⑤氯离子的检验方法是:加足量稀硝酸至呈酸性,然后滴加硝酸银溶液,若产生白色沉淀,则含有氯化钠,故答案为:加足量稀硝酸至呈酸性,然后滴加硝酸银溶液,若产生白色沉淀,则含有氯化钠.
点评:本题考查了原电池原理和电解池原理、除杂等知识点,难度较大,注意燃料电池中电极反应式的书写要结合电解质溶液的酸碱性,即使燃料和氧化剂相同,电解质溶液不同则电极反应式也不同,为易错点.

 2NaOH+H2↑+Cl2↑,
2NaOH+H2↑+Cl2↑, 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;

 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案